کارشناس خانه آبکار
کربنات پتاسیم
| پتاسیم کربنات | |
|---|---|
 |
|
 |
|
 |
|
| شناساگرها | |
| شماره ثبت سیایاس | 584-08-7 |
| شمارهٔ آرتیئیسیاس | TS7750000 |
| خصوصیات | |
| فرمول مولکولی | K2CO3 |
| جرم مولی | 138.2055 g/mol |
| شکل ظاهری | جامد سفید نمگیر |
| چگالی | 2.29 g/cm3 solid |
| دمای ذوب | 891 °C |
| دمای جوش |
تجزیه میشود.
|
| انحلالپذیری در آب | 112 g/100 mL (20 °C) |
| خطرات | |
| لوزی آتش |
 0
2
0
|
| نقطه اشتعال | غیر مشتعل |
پوششهاي فلزي - آزمون خوردگي به روش تيواستاميد ( روش (TAA)
پوششهاي فلزي - آزمون خوردگي به روش تيواستاميد ( روش (TAA)
مقدمه
تعداد و نوع نمونههاي مورد آزمون, زمان در معرض قرار گرفتن نمونه و نيز معيار غير قابل قبول بودن در اين استاندارد مشخص نشده است . چنين جزئياتي , بايد برحسب مشخصات محصول و يا پوشش ارائه شود.
1- هدف و دامنه كاربرد
1-1- هدف از تدوين اين استاندارد, تعيين روش آزمون مقاومت سطوح فلزي در برابر خوردگي, و كدر شدن در محيطهاي حاوي سولفيدهاي فرار, بر طبق مشخصات محصول يا پوشش, ميباشد .
1-2- اين آزمون, جهت سنجش كارآيي روشهايي كه براي جلوگيري از كدر شدن مس و نقره بكار ميروند و يا تشخيص ناپيوستگيهاي حاصل از پوشش فلزات مس و نقره توسط فلزات قيمتي, كاربرد دارد.
2- روش آزمون
2-1- اساس كار
نمونههاي مورد آزمون را, در معرض بخارات متصاعد شده از تيواستاميد, در فضايي با رطوبت نسبي 75 درصد و در حضور محلول اشباع استات سديم, قرار ميدهند .
2-2- مواد لازم
ياد آوري : صرفأ از مواد شيميايي شناخته شده ( با درجه خلوص آزمايشگاهي ) و از آب مقطر و يا آبي با درجه خلوص بالا, استفاده خواهد شد.
2-2-1- تيواستاميد, به صورت كريستالهاي ريز :
ياد آوري: تيواستاميد مادهاي است سرطان زا و لذا از تماس آن با پوست, بايد خود داري نمود.
2-2-2- محلول اشباع استات سديم كه آنرا از انحلال سه قسمت استات سديم داراي سه مولكول آب (CH3 COONa , 3H2O) در يك قسمت آب مقطر, بدست ميآورند.
استاندارد بررسی پوشش آبکاری شده نقره
استاندارد بررسی پوشش آبکاری شده نقره
- 1- مقدمه
در این استاندارد هدف بررسی پوشش آبکاری شده نقره می باشد. در این آزمون ویژگیهای خاص برای پوشش آبکاری شده نقره برای مصارف با اهداف مهندسی که شامل مات بودن، براقیت و خلوص نقره در پوشش مد نظر قرار گرفته است. پوشش نقره از نظر خواصی نظیر قابلیت لحیم کاری سطح، خواص تماس الکتریکی، هدایت الکتریکی و حرارتی بالا، اتصال به گرماسنج، مقاومت سایشی سطوح تحت تحمل فشار و انعکاس نوری مورد توجه است.
2- مراجع استاندارد ASTM
B 183 Practice for Preparation of Low-Carbon Steel for Electroplating
B 242 Practice for Preparation of High-Carbon Steel for Electroplating
B 252 Guide for Preparation of Zinc Alloy Die Castings for Electroplating Conversion Coatings
B 253 Guide for Preparation of Aluminum Alloys for Electroplating
B 254 Practice for Preparation of and Electroplating on Stainless Steel
B 281 Practice for Preparation of Copper and Copper-Base Alloys for Electroplating and Conversion Coatings
B 322 Practice for Cleaning Metals Prior to Electroplating
B 343 Practice for Preparation of Nickel for Electroplating with Nickel
B 374 Terminology Relating to Electroplating
B 481 Practice for Preparation of Titanium and Titanium Alloys for Electroplating
B 482 Practice for Preparation of Tungsten and Tungsten Alloys for Electroplating
B 487 Test Method for Measurement of Metal and Oxide Coating Thicknesses by Microscopical Examination of a Cross Section
B 499 Test Method for Measurement of Coating Thicknesses by the Magnetic Method: Nonmagnetic Coatings on Magnetic Basis Metals
B 504 Test Method for Measurement of Thickness of Metallic Coatings by the Coulometric Method
B 507 Practice for Design of Articles to be Electroplated on Racks
B 542 Terminology Relating to Electrical Contacts and Their Use
B 567 Test Method for Measurement of Coating Thickness by the Beta Backscatter Method
B 568 Test Method for Measurement of Coating Thickness by X-Ray Spectrometry
B 571 Test Methods for Adhesion of Metallic Coatings
B 578 Test Method for Microhardness of Electroplated Coatings
B 579 Specification for Electrodeposited Coatings of TinLead Alloy (Solder Plate)
B 602 Test Method for Attribute Sampling of Metallic and Inorganic Coatings
B 678 Test Method for Solderability of Metallic-Coated Products
B 697 Guide for Selection of Sampling Plans for Inspection of Electrodeposited Metallic and Inorganic Coatings
B 762 Method of Variables Sampling of Metallic and Inorganic Coatings
B 849 Specification for Pre-treatments of Iron or Steel for Reducing the Risk of Hydrogen Embrittlement
B 850 Guide for Post-Coating Treatments of Steel for Reducing the Risk of Hydrogen Embrittlement
D 3951 Practice for Commercial Packaging
E 1004 Practice for Determining Electrical Conductivity Using the Electromagnetic (Eddy-Current) Method
F 519 Test Method for Mechanical Hydrogen Embrittlement Evaluation of Plating Processes and Service Environments
3- طبقه بندی:
3-1 پوشش های آبکاری شده نقره باید بر اساس حداقل خلوص ، درجه براق بودن بصورت براق، نیمه براق یا مات، و ضخامت بر حسب میکرون طبقه بندی شوند.
طبقه بندی بر اساس خلوص بصورت زیر میباشد:
نوع 1-با حداقل خلوص 99.9%
نوع 2-با حداقل خلوص 99.0%
نوع 3- با حداقل خلوص 98%
نکته: بعضا برای اصلاح دانه بندی پوشش ممکن است از براق کننده های آلی یا معدنی استفاده شود که میتواند در پوشش نهایی وجود داشته باشند، استفاده از این ترکیبات تا زمانیکه با کارکرد پوشش تداخلی نداشته باشند بلامانع است.
3-3 ظاهر سطح- درجه بندی سطح بصورت کدهای زیر مشخص می گردد:
درجهA، مات- لایه ابکاری شده بدن براقیت، حاصل از محلول آبکاری فاقد هرگونه افزودنی براق کننده.
درجه B، براق- لایه آبکاری شده حاصل از محلولی که در آن عوامل افزودنی براق کننده اضافه شده است.
درجه C، براق- لایه آبکاری شده براقی است که جلای آن ناشی از اعمال پولیش مکانیکی یا شیمیایی بر روی پوشش درجه A است.
درجه D، نیمه براق، لایه آبکاری شده حاصل از افزایش عواملی در حمام آبکاری است.
3-4 پرداخت تکمیلی سطح- درجه بندی این پرداخت کاری تکمیلی بصورت کدهای زیر مشخص میشود:
طبقه N-A پرداخت کاری که مقاومتی در برابر تیره شدن نداشته است.
طبقه S-A پرداخت کاری که که در مقابل تیره شدن مقاوم باشد.
توجه: طبقه S جهت استفاده در ظروف آشپزخانه و نگهداری غذا مناسب نمی باشد.
4- مرتب سازی اطلاعت:
4-1 برای استفاده کامل از این استاندارد، توصیه میشود حتما اطلاعات زیر را در ارتباط با این استاندارد به فروشنده بدهید:
4-1-1 نام، طراحی و سال انتشار این استاندارد.
4-1-2 نوع, درجه طبقه و ضخامت پوشش آبکاری شده.
4-1-3 ماهیت بستر- اگر برای مثال بستر از نوع فولاد با استحکام بالا باشد، لازم است استرس و تردی تا حدی تضعیف شود. اگر بستر مس باشد، برای برخی کاربردها یک زیر لایه مورد نیاز است.
4-1-4 سطوح خاص
4-1-5 ظاهر
4-1-6 زیر لایه
4-1-7 برخی از تستها نیاز به برسی موارد زیر دارند: ضخامت، چسبندگی، سختی، نداشتن تردی، لحیم کاری، انعکاس نور، یا هدایت الکتریکی.
4-1-8 روشهای نمونه گیری و تضمین کیفیت
5- الزامات پوشش
5-1 ماهیت پوشش- پوشش نقره با توجه به نوع خاص آن، اساسا باید از یک محلول الکترولیت آبی تولید شود.
5-2 خلوص پوشش- ترکیب شیمیایی پوشش باید متناسب با نوع خاص پوشش باشد که در بخش 4-2 تعریف شد و اندازه گیری آن در بخش 8-6 توضیح داده خواهد شد.
5-3 فرایند:
5-3-1 برای انجام آبکاری و اطمینان ای فرایند آبکاری بدون نقص یکی از مهمترین بخشها، تمیز کاری سطح فلز مورد نظر است. بسته به نوع فلز پایه مواد پاک کننده متفاوتی برای فرایند تمیزکاری استفاده میشود. کلیه مواد پاک کننده الزاما باید به گونه ای انتخاب شوند که حداقل اسیبهای سطحی را به قطعه تحمیل کنند. از جمله این آسیبها میتوان موارد زیر را نام برد: ایجاد حفره، حمله به قسمتهای بین دانهای، استرس خوردگی یا ایجاد ترک و تردی هیدروژنی.
5-3-2 عملیات پیش آبکاری- عملیات نهایی آبکاری باید زمانی انجام بگیرد که کلیه مراحل مقدماتی عملیات مکانیکی و حرارتی از جمله شکل دهی، ماشینکاری و اتصالات قطعات به یکدیگر بصورت کامل انجام شده باشد.
نکته: با توجه به اینکه پوشش نقره ممکن است برای تسهیل عملیات مکانیکی از جمله غالبزنی و کشش مورد استفاده قرار بگیرند که در این موارد آبکاری نقره پیش از این مراحل اعمال می شود.
5-3-2-1 ترمیم استرس وارد شده به پوشش- قسمت های ساخته شده از استیل با استحکام کششی MPa 1000 یا بیشتر (سختی بالاتر از 31 HRC یا بیشتر) که ماشین کاری شده باشند، و یا اینکه برای کشش سرد یا گرم تحت آماده سازی حرارتی قرار گرفته باشند، ممکن است بنا به خواست خریدار نیاز باشد تا برای ترمیم تنش وارد شده تحت آمایش حرارتی قرار بگیرند. برای این منظور تست B 849 پیشنهاد می شود.
5-3-3 آستر- برای بهینه سازی چسبدگی پوشش نهایی نقره باید یک آستر نقره یا طلا روی کار انجام بگیرد.
5-3-4 زیر لایه- زمانیکه محصول مورد نظر از مس یا آلیاژهای مس ساخته شده باشد، یک لایه میانی از نیکل یا آلیاژی از نیکل با حداقل 1 میکرومتر ضخامت پیش از آبکاری نقره باید بکار گرفته شود. زیر لایه نیکل بنابر دلایل دیگری نیز الزام آور است.
5-3-5 فرایندهای پسا آبکاری
5-3-5-1 ترمیم نواقص- قسمتهای ساخته شده از فولادهایی با استحکام کششی بالای MPa 100 یا بیشتر (سختی HRC 31 یا بیشتر)، و همچنین قسمتهای سخت شده سطح، ممکن است به یک پسا پوشش جهت ترمیم تردی هیدروژنی احتیاج داشته باشد بویژه زمانیکه مقدار استحکام کششی توسط خریدار مشخص میشود. ممکن است مشخصات B850 برای لیستی که عموما جهت پسا آماده سازی استفاده میشود پیشنهاد گردد.
5-4 ظاهر سطح- سطح پوشش آبکاری شده باید گرید مناسب تعریف شده در بخش 4-3 را داشته باشد.
5-5 پسا آماده سازی تکمیلی- پوشش باید نیازهای خاصی که برای طبقه بندی پوشش در بخش 4-4 تعریف شد را داشته باشد.
5-6 ضخامت- ضخامت پوشش نقره بر روی سطوح معین باید حداقل ضخامت ممکن را (ضمیمه 3) زمانی که به روش قید شده در بخش 8-2 انجام می گیرد داشته باشد.
5-7 ظاهر- پوشش حاصل از آبکاری نقره بر روی سطح قطعه باید بطور کامل سطح را پوشانده و به لحاظ ظاهر و رنگ یکنواخت باشد. اگر در مرحله بعد عملیات پسیو کردن روی سطح نقره انجام بگیرد، یکواختی رنگ چندان الزام آور بنظر نمی رسد.
5-7-1 نواقص- نواقص در سطح فلز پایه از قبیل، خراش، حفره ها، قسمتهای غیر قابل دسترس و علامتهای ناشی از کشش وبرش ممکن است بر روی عملکرد و ظاهر پوشش تاثیر بگذارند. چنین نواقصی که علی رغم آبکاری خوب فلز، در پایان فرایند باقی می مانند نباید باعث رد شدن شود.
نکته: اساسا زمانیکه سطح قطعه عاری از هر نوع نقصی باشد، به تبع پوششهای آبکاری شده نیز با کیفیت بسیار بهتری حاصل خواهند شد.
5-8 چسبندگی- پوشش های نقره نباید بصورت تبله کرده یا پوسته پوسته باشند که نشان از جسبندگی ضعیف پوشش است.
5-9 قابلیت لیحم کاری- سطوح آبکاری شده نقره باید پوشش هایی تولید کنند که براق، یکنواخت و صاف باشد. سطح نمونه زمانیکه طبق روش بیان شده در بخش 8-5 تست می شود، باید حداقل 95% تر شوندگی خوب نشان دهد.
5-10 نیازهای تکمیلی:
5-10-1 سختی- اگر سختی خاصی مد نظر باشد در چنین شرایطی سختی پوشش نقره باید طبق روش بیان شده در بخش 8-7 اندازه گیری شود.
5-10-2 بازتابش نور- اگر به یک بازتابش خاصی نیاز باشد در اینصورت بازتابش نوری پوشش نقره باید روش مطرح شده در بخش 8-8 اندازه گیری شود.
5-10-3 هدایت الکتریکی- در صورت به یک هدایت الکتریکی خاص، هدایت الکتریکی پوشش حاصل از نقره باید مطابق روش مطرح شده در بخش 8-9 اندازه گیری شود.
6- نمونه برداری:
6-1 یک نمونه تصادفی از اندازه مورد نیاز توسط روش B 602 یا روش B 762 از میان تعداد زیادی نمونه که بازرسی شده اند باید انتخاب شود. قطعات موجود در بخش باید برای هر نیازی مطابق با معیارهای طرح های نمونه گیری در روش انتخاب شده بصورت تایید شده و تایید نشده تقسیم بندی شوند.
6-2 قطعات مورد بازرسی باید بعنوان مجموعه ای تعریف شوند که در آن قطعات پوشش داده شده از نوع مشابهی هستند که با ویژگیهای مشابه ، توسط یک تولید کننده یکسان و حتی المقدور در زمان یکسان و یا حداقل زمان مشابه، ضرورتا تحت شرایط یکسان تولید شده باشند و برای پذیرش یا عدم پذیرش برای گروه ارسال می شوند.
6-3 اگر برای بررسی پوشش، نمونه های خاصی جهت تست مورد استفاده قرار بگیرند، این نمونه ها ای ماهیت، اندازه و تعدادیکسانی با آنچه که در بخش 8-1 تعریف شده اس داشته باشند.
7- روش انجام تست:
7-1 نمونه های تست ویژه:
7-1-1 نمونه های تست ویژه زمانی استفاده می شوند که نمونه اصلی شکل، اندازه یا حنس مناسبی جهت بررسی پوشش نداشته باشد و یا اگر مشکلات فوق را نداشته باشد بدلیل گران بودن یا کم بودن تعداد امکان تخریب قطعه جهت مطالعه پوشش وجود نداشته باشد. امکان یا الزام استفاده از نمونه ویژه جهت تست، جنس آن و همینطور شکل و اندازه آن همگی باید توسط خریدار عنوان شود.
7-1-2 نمونه آزمایش ویژه باید خصوصیاتی که ویژگیهای نمونه مورد آزمایش اصلی را تحت تاثیر قرار می دهند را داشته باشد و فرایندهایی راکه از طریق آنها ممکن است ویژگیهای قطعه تغییر بکند را طی کرده باشد.
7-1-3 گونه آزمایش ویژه که برای تست چسبندگی، لحیم کاری یا بررسی ظاهر استفاده می شود، باید همجنس قطعه اصلی باشد، شرایط متالورژیکی یکسانی داشته باشد و از نظر سطح، شرایط یکسانی داشته باشد. این گونه باید در بخش نمونه های اصلی قرار بگیرد تا تحت همان فرایندهای مشابهی که قطعه اصلی تجربه می کند قرار داشته باشد.
7-1-4 نمونهها آزمایش ویژه یکه برای انجام تست ضخامت استفاده میشوند باید وارد فرایندی شود که در آنجا پوشش اعمال می شود و از طریق کلیه مراحلی که ضخامت پوشش دارای تحمل است، باید انجام شود.
7-2 ضخامت- ضخامت پوشش باید در قسمتهای معینی از سطح اندازه گیری شود که انتظار می رود بصورت تخریبی یا غیر تخریبی، در کمترین میزان خود باشد.
7-2-1 شرایط اندازه گیری غیر تخریبی- اندازه گیری ضخامت پوشش نقره بوسیله beta backscatter (روش آزمایش B567)، توسط اسپکترومتری پراش پرتو X (روش تست B 568) یا بوسیله روش مغناطیسی ( روش تست B 499).
7-2-2- شراط اندازه گیری تخریبی- اندازه گیری ضخامت پوشش نقره توسط روشهای کالریمتری (روش تست B 504) یا توسط فرایندهای میکروسکوپی cross-sectioning (روش تست B 487).
چسبندگی- تعیین چسبندگی بصورت کیفی با یکی از روشهایی که در روش تست B 571 آمده است قابل انجام است. سایر فرایندها از قبیل ماشینکاری یا استفاده از shot peening هم می تواند مورد استفاده قرار بگیرد.
7-4 ترمیم تردی هیدروژنی- برای محصولات فولادی لازم است مطابق آنچه در بخش 6-3-5-1 گفته شد، برای حذف تردی هیدروژنی آمایش حرارتی انجام شود که این فرایند باید طبق دستورالعمل روش F 512 بوسیله نمونه آزمایشی ویژه که در بخش 8-1 ذکر شد ارزیابی شود.
7-5 قابلیت لحیم کاری- تعیین کیفی قابلیت لحیم کاری توسط تست B 678 انجام می گیرد.
7-6 خلوص پوشش- تعین ترکیب پوشش نقره با تعیین ناخالصی هایی (ترکیبات متفاوت با نقره) توسط طیف سنجی نشری، فل.رسانس x-ray، جذب اتمی یا سایر روشها با خطای کمتر از 0.01% بصورت کمی قابل اندازه گیری است.
7-7 سختی- سختی پوشش را با استفاده از روش B 578 میتوان اندازه گیری نمود.
7-8 باتاب نوری- بازتاب نوری در محدوده طیفی 0.60 60.05 µm بر روی یک سطح پوشش داده شده با استفاده از یک دستگاه مناسب برای تعیین زاویه 45° به منظور بدست آوردن یک زاویه باریک قابل پذیرش (مناسب برای آبکاری آینه) انجام می گیرد.
7-9 هدایت الکتریکی- اندازه گیری هدایت الکتریکی توسط روش تست E 1004 با استفاده از نمونه آزمایشی ویژه انجام می گیرد.
ضمایم:
سختی
سختی پوشش نقره غیر آلیاژی به مراتب بالاتر از نقره آنیل شده می باشد که احتمالا دلیل آن مناسب بودن اندازه ذرات می باشد. ترکیب الکترولیت، پارامترهای عملیات آبکاری و شرایط ترسیب همگی بر روی سختی موثر هستند. همچنین وجود مقدار کمی مواد آلی و غیر آلی بعنوان براق کننده تاثیر مستقیمی بر روی سختی پوشش دارد.
تیره شدن نقره:
در محیطهای حاوی سولفور، بلافاصله بر روی نقره یک فیلم سولفیدی کدر تشکیل می شود. حضور سولفور آزاد در ترکیب لاستیک و مواد مقوایی سرعت تشکیل فیلم سولفید نقره را افزایش می دهد. تشکیل این فیلم علاوه بر کدر کردن سطح قطعه باعث افزایش مقاومت الکتریکی نقره شده و قابلیت لحیم کاری نقره را کاهش میدهد. استفاده از ترکیبات ضد تشکیل دهنده این ترکیب سولفیدی بطور موثری کمک کننده خواهد بود.
این مواد ضد تیره کنندگی سطخح نقره که بصورت تجاری در دسترس می باشند بر اساس کرومات، ترکیبات آلی هستند. عموما قطعه را در حمام حاوی کروم کرده و با تشکیل یک لایه کرومات غیر فعال سطح نقره در مقابل واکنش با سولفور غیر فعال می شود.
معرفی کتاب باتری اشکانی پروفسور کنعانی
معرفی کتاب باتری اشکانی پروفسور کنعانی
چکیده کتاب
اولین نشانه چگونگی تولید الکتریسیته در سال ذ1791-2 را به دانشمندان ایتالیایی،"لوئیجی گالوانی" نسبت می دهند.گالوانی با یک مشاهده معمولی ، ولی کاملا اتفاقی به پدیده ی "الکتریسیته در جریان" در مقابل"الکتریسیته ساکن" دسترسی یافت.
هموطن وی "الکساندر ولتا" دستگاهی بر اساس مشاهدات اتفاقی گالوانی اختراع نمود که اولین باطری الکتریکی و یا به نام اون "پیل ولتا نیک" لقب گرفت و به عنوان منبع ثابت الکتریسیته کارایی داشت.
بدین ترتیب گالوانی مشوق اصلی ولتا جهت ساخت یک منبع تولید برق شد که مبنای کارکرد آن مبتنی بر تلفیقی از علوم شیمی و فیزیک بود.
باید اذعان داشت که اختراع ولتا به عنوان اولین روش تولید الکتریسیته پیوسته واقعا یک کشف عظیم علمی محسوب میگردد.از آنجائیکه سلول الکتریکی ولتا برای اولین بار جریانهای بالای الکتریکی تولید میکرد به یک پدیده بحث انگیز و جنجالی تبدیل گردید.انیان امروزی که از برق به عنوان یک منبع قدرتمند انرژی استفاده میکند،باید خودرا مدیون تحقیقات و اختراعات این دونفر بداند.کشف این دو دانشمند در قرن هجدهم را میتوان عامل اصلی وقوع "عصر نیروی برق" دانست ، که تنوع کاربرد های آن باعث ایجاد دگرگونی بسیار شگرفی در تمدن امروز بشری گردیده است.
متن زیر از کتاب باتری اشکانیان جناب پروفسور کنعانی استخراج گردیده است
«تاریخچه ی کشف باتری اشکانی»
اولین نشانهی چگونگی تولید الکتریسیته در سال 2-1791 را به دانشنمند ایتالیایی، «لوئیجی گالوانی» نسبت میدهند. گالوانی با یک مشاهدهی معمولی، ولی کاملاً اتفاقی به پدیدهی «الکتریسیتهی در جریان» درمقابل «الکتریستهی ساکن»، دسترسی یافت.
هموطن وی «الکساندر ولتا»، دستگاهی براساس مشاهدات اتفاقی گالوانی، اختراع نمود که اولین باتری الکتریکی که بهنام او ثبت گردید، «پیل ولتا نیک» و یا «پیل ولتا» لقب گرفت و به عنوان منبع ثابت الکتریسیته، کارایی داشت.
گالوانی و ولتا فقط مجدداً کشف کردند
در کلیه کتب مرتبط با تاریخ علوم، تا سال 1938 باتری الکتریکی را صرفاً اختراع ولتا در سال 1800 تلقی میکنند. کشف یک ظرف کوچک در نزدیکی بغداد درسال 1936، این احتمال را قوت بخشید که ولتا کاشف باتری نبوده و صرفاً آن را مجدداً کشف کرده است. استخراج این ظرف بههمراه سایر یافتههای باستانی موجب شد تا ویلهلم کونیک (Wilhelm Konig) فرضیهی جسورانهای را که درسال 1938 باعنوان «پیل گالوانیک» کشف شده، ارائه نماید.
یکی از بزرگترین و گسترده ترین امپراطوریهای تمام دوران که به ایران قدیم و کشورهای همسایه سلطنت کردند، توسط یک قوم ایرانی به نام اشکانیان در 250 سال قبل از میلاد تا 250 سال بعداز میلاد بنیانگذاری گردیـد. آنها خود را دارای تمدنـی با فرهنگ غنی و ثروت عظیـم دراین امپراطـوری وسیع میدانسته اند. شواهد و مستندات بیشماری مانند: مسکوکات، ظروف نوشیدنی شاخ گونه و ظروف سفالی که تاکنون کشف شده اند دلالت بر تمدن عظیم اشکانیان دارد.
اکتشافات باستانی توسط گروههای مختلف در شهر تیسفون در سالهای 1930 و 1936 منجربه کشف اشیای شگفت انگیزی مانند ظروف گلی (سفالی)، استوانه ای مسی و میله های آهنی گردید که تا سال 2003 (موسوم به جنگ خلیج فارس در عراق) در تملک موزه ی ملی عراق در بغداد بود.
درسال 1936، تعدادی اشیای خاص مانند یک ظرف سفالی، با ارتفاع 14 و عرض 8 سانتیمتر، یک استوانهی مسی و یک میله ی آهنی باریک در منطقه ی خیوت ربوعه(Khujt Rabboua) در نزدیکی شهر تیسفون کشف گردید. از آنجایی که این محدوده، یک منطقه ی مسکونی اشکانی محسوب گردید، یافته های باستانی را متعلق به دوران امپراطوری اشکانیان میدانستند.
دریچه ی تنگ توخالی سفالی، توسط درپوشی از جنس آسفالت پوشیده شده بود و استوانهای که از جنس ورق مس نورد شده به شکل لوله درآمده بود، در پایین به یک دیسک مسی متصل و توسط آسفالت در مکان خود محکم میشود. میله ی آهنی کاملا زنگ زده بود.
کاربرد واقعی اشیای کشف شده در منطقهی خیوت ربوعه، کاملاً ناشناخته بود. باستانشناس اطریشی به نام ویلهلم کونیگ (Wilhelm konig) اولین شخصی بود که این اشیا را مورد بررسی قرار داد. او معتقد بود که آنها اجزای یک باتری الکتریکی هستند و سپس چنین استنتاج نمود که اگر تعدادی از آنها به هم متصل شوند، زرگران اشکانی توان تولید الکتریسیته ی کافی برای آبکاری لایه های طلا برروی اشیای فلزی را دراختیار داشتند. این آبکاری به منظور ارتقای کیفی و افزایش بهای آنها انجام میشده است.
*کشف و تبدیل باتری جهت تولید ولتاژ توسط ایرانیان
هنگامی که مدلی از این «باتری»، (از این پس به نام «باتری اشکانی» و یا «باتری بغداد» نامیده خواهدشد) توسط سولفات مس، سرکه و یا حتی آب گریپ فروت ترش به عنوان محلول الکترولیت پر گردید، مشاهده شد که این مجموعه میتواند ولتاژ تولید نماید. براساس مشاهدات این آزمون، تنوع نظرات مطرح گردید. بهعنوان مثال، هسته ی خردشده ی بادام تلخ و یا آلبالو، کمی مایع خمیر، آب، حرارت و گرد طلا میتوانستند تا محلول سیانید طلا برای آبکاری طلا توسط این باتری را تولید نمایند.
البته، کلیه ی دانشمندان با کاربرد این یافته ی باستانی بهعنوان یک منبع تغذیه که زرگران اشکانی برای آبکاری طلا از آن استفاده میکردند، موافق نبودند. برخی از آنها اعتقاد داشته و دارند که احتمالاً این «باتری» یک منبع آماده ی الکتریکی و یا وسیله ای مشابه با آن برای دادن «شوک الکتریکی» به بیماران بوده است. کاربردهای دیگری مانند استفاده ی ظرف سفالی و محتوی آن برای آیینهای مذهبی نیز مطرح شده است. بدین ترتیب که اینگونه متون که برروی مواد عالی درج میگردیده، درون اینگونه ظروف نگهداری میشده است.
پس از کشف این یافته های باستانی، در شصت سال اخیر، دانشمندان زیادی از سراسر دنیا تحقیقات حجیم و گستردهای بر روی انواع مدلهای شبیه سازی شده از آن را، جهت تأئید و یا رد فرضیه ی کونیگ انجام دادهاند.
نشریه صنعت آبکاری شماره 81
فهرست مطالب
قدردانی
چهارمین جشنواره صنعت آبکاری
گزارش تصویری
آبکاری طلای سخت گنبدها و گلدسته ها
سیمای آبکار
آبکاری موضعی یاتاقان ها
نشریه صنعت آبکاری 80
فهرست مطالب
جشنواره صنعت آبکاری
آبکاری بروی پلاستیک ها
جشنواه صنعت آبکاری اوج نمایش پیشرفت فرهنگی
سیستم های سرمایشی و گرمایشی در خطوط آبکاری
سیمای آبکار
مروری بر روش های حذف فلزات سنگین از پساب
کلریدریک اسید مشخصات
هیدروکلریک اسید یک محلول شفاف، بیرنگ و بسیار تند بو از هیدروژن کلرید (HCl) در آب است. یک اسید معدنی بسیار خوردنده و یک اسید قوی با استفادههای صنعتی زیادی است. هیدروکلریک اسید به طور طبیعی در اسید معده یافت میشود. پیاچ (pH) این اسید بین ۰ تا ۲۲ میباشد.
هیدروکلریک اسید از قدیم به نامهای اسیدم سالیس، موریاتیک اسید و ارواح نمک معروف بوده و از ویتریول (سولفوریک اسید) و نمک طعام به دست آمد. هیدروکلریک اسید آزاد ابتدا در قرن شانزدهم توسط آندریاس لیباویوس رسماً معرفی شد. بعدتر، توسط شیمیدانهایی مثل ژوهان رودولف گلابر، جوزف پریستلی و همفری دیوی در تحقیقات علمی شان مورد استفاده قرار گرفت.
با آغاز تولید گسترده در انقلاب صنعتی، هیدروکلریک اسید در صنایع شیمیایی بعنوان یک واکنش گر ناب در تولید مقیاس بزرگ وینیل کلرید برای پلاستیک PVC، و MDI/TDI برای پلی یورتان مورد استفاده قرار گرفت. کاربریهای زیادتری هم در مقیاس کوچک دارد که شامل خانهداری، ساخت ژلاتین و دیگر افزودنیهای غذایی، رسوبزدایی و چرم سازی میباشد. حدود ۲۰ میلیون تن از هیدروکلریک اسید سالانه در جهان تولید میشود.
همچنین گفته میشود جابر بن حیان این اسید را کشف کرده است. ازاین اسید برای جرم گیری از سطوح مختلف استفاده میشود. هیدروکلریک اسید در معده نیزوجود دارد و به هضم غذا کمک میکند. تنفس بخارات هیدروکلریک اسید خطرناک است و به دستگاه تنفسی آسیب میرساند و اگر قطرهای از آن بر روی پوست بدن بچکد تولید تاول و حتی جراحات عمیق مینماید ودرچنین مواردی باید بلافاصله با محلول قلیایی رقیق مانند محلول سودا یا جوش شیرین اثر اسید را خنثی کرد.
محتویات
۱وجه تسمیه۲تاریخچه
۳خواص شیمیایی و واکنشها
۴خواص فیزیکی
۵تولید
۵.۱بازار صنعتی
۶کاربردها
۶.۱اسیدشویی فولاد
۶.۲تولید ترکیبات آلی
۶.۳تولید ترکیبات غیرآلی
۶.۴کنترل pH و خنثی سازی
۶.۵بازسازی مبدلهای یونی
۶.۶دیگر کاربرد های هیدروکلریک اسید
۷حضور در موجودات زنده
۸ایمنی
۹جستارهای وابسته
۱۰پیوند به بیرون
۱۱منابع
وجه تسمیه
هیدروکلریک اسید برای کیمیاگران اروپایی با عنوان ارواح نمک یا اسیدم سالیس (نمک اسید) شناخته شده بود. هر دو نام هنوز هم رایج هستند به خصوص در زبانهای غیر انگلیسی مثل زبان آلمانی: Salzsäure، زبان هلندی: Zoutzuur، زبان سامی شمالی: Saltsyra و زبان لهستانی: kwas solny. HCl گازی هوای اسید دریایی نامیده میشد. نام قدیمی (قبل از نام قاعده دار) موریاتیک اسید نیز ریشهٔ یکسانی دارد و بعضی اوقات به کار میرود (موریاتیک یعنی "مربوط به آب نمک یا نمک").[۱][۲]نام «هیدروکلریک اسید» توسط شیمیدان فرانسوی ژوزف لویی گیلوساک در ۱۸۱۴ ابداع شد.[۳]
تاریخچه
تیزاب سلطانی، مخلوطی از هیدروکلریک اسید و نیتریک اسید، که با حل شدن نشادر در نیتریک اسید تهیه میشود، توسط سئودو گبر (جابر بن حیان بدلی)، شیمیدان اروپایی قرن ۱۳ تشریح شد.[۴][۵][۶][۷][۸] دیگر مراجع اذعان دارند که اولین اشاره به تیزاب سلطانی در دست خطهای موجود امپراتوری روم شرقی با تاریخ اواخر قرن سیزدهم یافت شده است.[۹][۱۰][۱۱]
هیدروکلریک اسید آزاد اولین بار به صورت رسمی در قرن ۱۶ توسط آندریاس لیباویوس معرفی شده است که آن را با گرم کردن نمک در بوته چینی خاک رسی به دست آورد.[۱۲] دیگر نویسندگان ادعا میکنند که هیدروکلریک اسید خالص اولین بار توسط کاهن بندیکتی باسیل والنتین آلمانی در قرن ۱۵،[۱۳] با گرم کردن نمک طعام معمولی و آهن(II) سولفات کشف شده است.[۱۴] درحالیکه دیگران مدعی اند که هیچ مرجع قابل اعتمادی راجع به اینکه هیدروکلریک اسید خالص تا اواخر قرن شانزدهم به دست آمده باشد، وجود ندارد.[۱۵]
در قرن هفدهم، ژوهان رودولف گلابر از کارل اشتات آم ماین از نمک سدیم کلرید و سولفوریک اسید برای تهیهٔ سدیم سولفات در واکنش مانهایم استفاده کرد که گاز هیدروژن کلرید آزاد میکرد. جوزف پریستلی از لیدز انگلستان، هیدروژن کلرید خالص را در ۱۷۷۲ تهیه کرد،[۱۶] و در ۱۸۰۸ همفری دیوی از پزانس انگلستان، ثابت کرده بود که ترکیب شیمیایی شامل هیدروژن و کلر بوده است.[۱۷]
همزمان با انقلاب صنعتی در اروپا، تقاضا برای مواد قلیایی افزایش یافت. فرایند جدیدی توسط نیکولاس لبلانک (ایسودان، فرانسه) تولید ارزان قیمت و گستردهٔ سدیم کربنات (جوش شیرین) را ممکن کرد. در این فرایند لبلانک، نمک طعام با استفاده از سولفوریک اسید، سنگ آهک و زغال سنگ ضمن آزاد کردن هیدروژن کلرید به عنوان فرآوردهٔ جانبی، به جوش شیرین تبدیل میشود. تا زمان قانون قلیایی ۱۸۶۳ در برتانیا و قوانین مشابه در دیگر کشورها، HCll اضافی وارد هوا میشد. بعد از قانون گذاری، تولیدکنندگان جوش شیرین مجبور به انتقال گاز اتلافی به آب و جذب آن در آب شدند تا هیدروکلریک اسید در مقیاس صنعتی تولید کنند.[۱۸]
در قرن بیستم، فرایند لبلانک جای خود را به فرایند سولوای که فرآوردهٔ جانبی هیدروکلریک اسید تولید نمیکرد و موثرتر بود، داد. به خاطر آن که هیدروکلریک اسید همچنان بعنوان یک ماده شیمیایی مهم در کاربردهای متعدد شناخته میشد، میل تجاری روشهای تولید دیگری را نیز موجب شد که برخی همچنان به کار گرفته میشوند. بعد از سال ۲۰۰۰، هیدروکلریک اسید بیشتر با جذب هیدروژن کلرید اضافی از تولید ترکیبات آلی صنعتی تولید میگردد.[۱۸]
از ۱۹۸۸، هیدروکلریک اسید با عنوان پیشرو در جدول دوم پیمان نامه سازمان ملل علیه خرید و فروش غیرقانونی مواد مخدر و مواد روانگردان در سال ۱۹۸۸ به علت استفاده از آن در تولید و ساخت هروئین، کوکائین و مت آمفتامین ذکر شده است.[۱۹]
خواص شیمیایی و واکنشها
هیدروژن کلرید (HCl) اسید تک پروتونی است، به این معنی که میتواند فقط یک بار تفکیک شود (مثلا یونیزه) تا یک یون H+ (یک پروتون تنها) آزاد کند. در هیدروکلریک اسید آبی، H+ به یک مولکول آب میپیوندد تا یک یون هیدرونیوم، H3O+ تشکیل دهد:[۲۰][۲۱]
- HCl + H2O → H3O+ + Cl−
دیگر یون تشکیل شده Cl−، یون کلرید است؛ بنابراین هیدروکلریک اسید میتواند برای تهیه نمکهای کلرید، مثل سدیم کلرید به کار رود. هیدروکلریک اسید یک اسید قوی است چون در اصل به طور کامل در آب تفکیک میشود.
اسیدهای تک پروتون دار یک ثابت تفکیک اسیدی، Ka، دارد که نشانگر میزان تفکیک در آب است. برای یک اسید قوی مثل HCl، مقدار Ka بزرگ است. تلاشهای نظری برای اختصاص یک Ka به HCl انجام پذیرفتهاند.[۲۲] وقتی نمکهای کلرید مثل NaCl به HCl آبی اضافه میشوند، عملاً تأثیری بر pH ندارند، این یعنی که Cl− یک باز مزدوج بسیار ضعیف است و HCl کاملاً در محلول آبی تفکیک شده است. برای محلولهای متوسط تا قوی هیدروکلریک اسید، فرض اینکه مولاریتهی H+ (یک یکای غلظت) دقیقاً برابر با مولاریتهٔ HCl است، با توجه به چهار رقم معنی دار درست است.
از بین شش اسید معروف قوی از اسیدهای معدنی در شیمی، هیدروکلریک اسید، یک پروتون دارد و کمترین تمایل را به شرکت در یک واکنش اکسایش-کاهش دارد. برخلاف اسیدی بودن آن، یکی از کم خطرترین اسیدها برای استفاده است زیرا شامل یون کلرید واکنش ناپذیر و غیر سمی است. محلولهای نسبتاً قوی هیدروکلریک اسید ضمن نگهداری شان کاملاً پایدار هستند و غلظت آنها در زمان ثابت میماند. این ویژگیها به علاوهٔ این که به عنوان یک واکنشگر ناب خالص در دسترس است، هیدروکلریک را به یک واکنش گر اسیدی عالی مبدل میسازد.
هیدروکلریک اسید یک اسید مطلوب در تیتراسیون برای تعیین مقدار بازها است. تیترانتهای اسید قوی نتایج دقیق تری به خاطر نقطه پایانی متمایزشان میدهند. آزئوتروپ یا (محلول نقطه جوش ثابت) هیدروکلریک اسید (تقریبا ۲۰٫۲٪) را میتوان به عنواناستاندارد اولیه در تحلیلهای کمی به کار برد اگرچه، غلظت دقیق آن به فشار جوی که در آن تهیه شده است، بستگی دارد.[۲۳]
استفاده از هیدروکلریک اسید در شیمی تجزیه برای تهیه محلولها (ی "ساده") جهت تجزیه بسیار رایج است. هیدروکلریک اسید غلیظ گاز هیدروژن، کلریدهای فلز اکسید شده و فلزهای زیادی را در خود حل میکند و با ترکیبهای بازی مثل سدیم کربنات یامس (II) اکسید واکنش داده و کلریدهای حل شدهای را ترکیب میکند که قابل تحلیل هستند.
خواص فیزیکی
| غلظت | چگالی | غلظت مولار | پیاچ | گرانروی | ظرفیت گرمایی | فشار بخار | نقطه جوش | دمای ذوب | ||
|---|---|---|---|---|---|---|---|---|---|---|
| kg HCl/kg | kg HCl/m3 | Baumé | kg/L | mol/dm3 | mPa•s | kJ/(kg•K) | kPa | °C | °C | |
| ۱۰٪ | ۱۰۴٫۸۰ | ۶٫۶ | ۱٫۰۴۸ | ۲٫۸۷ | −۰٫۵ | ۱٫۱۶ | ۳٫۴۷ | ۱٫۹۵ | ۱۰۳ | −۱۸ |
| ۲۰٪ | ۲۱۹٫۶۰ | ۱۳ | ۱٫۰۹۸ | ۶٫۰۲ | −۰٫۸ | ۱٫۳۷ | ۲٫۹۹ | ۱٫۴۰ | ۱۰۸ | −۵۹ |
| ۳۰٪ | ۳۴۴٫۷۰ | ۱۹ | ۱٫۱۴۹ | ۹٫۴۵ | −۱٫۰ | ۱٫۷۰ | ۲٫۶۰ | ۲٫۱۳ | ۹۰ | −۵۲ |
| ۳۲٪ | ۳۷۰٫۸۸ | ۲۰ | ۱٫۱۵۹ | ۱۰٫۱۷ | −۱٫۰ | ۱٫۸۰ | ۲٫۵۵ | ۳٫۷۳ | ۸۴ | −۴۳ |
| ۳۴٪ | ۳۹۷٫۴۶ | ۲۱ | ۱٫۱۶۹ | ۱۰٫۹۰ | −۱٫۰ | ۱٫۹۰ | ۲٫۵۰ | ۷٫۲۴ | ۷۱ | −۳۶ |
| ۳۶٪ | ۴۲۴٫۴۴ | ۲۲ | ۱٫۱۷۹ | ۱۱٫۶۴ | −۱٫۱ | ۱٫۹۹ | ۲٫۴۶ | ۱۴٫۵ | ۶۱ | −۳۰ |
| ۳۸٪ | ۴۵۱٫۸۲ | ۲۳ | ۱٫۱۸۹ | ۱۲٫۳۹ | −۱٫۱ | ۲٫۱۰ | ۲٫۴۳ | ۲۸٫۳ | ۴۸ | −۲۶ |
| دما و فشار مرجع برای جدول فوق ۲۰˚C و ۱ اتمسفر (101.325 kPa) است. مقادیر فشار بخار از جداول بینالمللی بحرانی اخذ شدهاند و همان فشار بخار کل محلول هستند. | ||||||||||

خواص فیزیکی هیدروکلریک اسید، مثل نقطه جوش و دمای ذوب، چگالی و pH بستگی به غلظت یا مولاریته HCl در محلول آبی دارند که از خواص آب در غلظتهای نزدیک به ۰٪ اسید تا مقادیر بخاری هیدروکلریک اسید در بیش از 40% HCl متغیر هستند.[۲۶]
هیدروکلریک اسید به عنوان مخلوط دوتایی (دو جزئی) از HCl و H2O آزئوتروپ نقطه جوش ثابتی در 20.2% HCl و ۱۰۸٫۶ ˚F (227 ˚F) دارد. چهار نقطه اوتکتیک ثابت بلوری شدن برای هیدروکلریک اسید، بین شکلهای بلور HCl•H2O (68% HCl)، HCl•2H2O (51% HCl)، HCl•3H2O (۴۱٪)، HCl•6H2O (25% HCl) و یخ (0% HCl) وجود دارد. هم چنین نقطه ثابت اوتکتیک در ۲۴٫۸٪ بین یخ و بلور HCl•3H2O موجود است.
تولید
هیدروکلریک اسید با حل شدن هیدروژن کلرید در آب تهیه میشود. هیدروژن کلرید را میتوان با روشهای گوناگونی تولید کرد و این یعنی راههای زیادی برای ساخت هیدروکلریک اسید موجودند. تولید مقیاس بزرگ هیدروکلریک تقریباً همیشه با تولید در مقیاس صنعتی دیگر مواد شیمیایی انجام میپذیرد.
بازار صنعتی
هیدروکلریک اسید در محلولهای تا ۳۸٪ از HCl (مقدار غلیظ) تهیه میشود. غلظتهای بیشتر فقط تا ۴۰٪ از نظر شیمیایی قابل تولید هستند، اما نرخ تبخیر از آن به بعد به قدری بالا است که نگهداری و استفاده از آن نیازمند ملاحظات اضافی تری است مثل دما و فشار پایین. پس میزان عمدهٔ صنعتی آن ۳۰٪ تا ۳۴٪ است که با توجه به حمل و نقل مناسب و اتلاف مادهٔ محدود به علت بخارهای HCl بهینه شده است. غلظتهای بیشتر را به جهت کنترل اتلاف از طریق تبخیر باید فشرده و سرد نمود. در ایالات متحده، محلولهای بین ۲۰٪ تا ۳۲۲٪ با نام اسید موریاتیک فروخته میشوند. محلولهای مورد استفاده اغلب برای نظافت خانهها در ایالات متحده، معمولاً ۱۰٪ تا ۱۲۲٪ هستند که هشدارهای جدی برای رقیقتر کردن شان قبل از استفاده دارند. در بریتانیا، که با نام «ارواح نمک» برای نظافت خانگی فروخته میشود، قدرت اسید برابر همان مقدار در ایالات متحده است.
تولید کنندگان بزرگ جهانی شامل شرکت داو کمیکال ۲ میلیون تن در سال از HCl گازی، شرکت جرجیا گالف، شرکت توسوه، آکزونوبل و تساندرلو بین ۰٫۵ تا ۱٫۵ میلیون تن در سال تولید دارند. تولید کل جهان، که برای استفادههای آماری بر اساس میزان HCl توصیف شده است، حدود ۲۰ میلیون تن در سال تخمین زده میشود که ۳ میلیون تن از طریق تولید مستقیم و مابقی از طریق استفاده از ترکیبهای آلی و مشابه و تولید فرآوردهٔ ثانوی تأمین میگردند. تا کنون، غالب هیدروکلریک اسید منحصراً توسط تولید کننده مصرف میشود. میزان آن در بازار آزاد جهانی ۵۵ میلیون تن در سال تخمین زده میشود.
کاربردها
هیدروکلریک اسید یک اسید قوی غیر آلی است که در اکثر فرآیندها مثل پالایش فلزات به کار میرود. استفادهٔ مورد نظر معمولاً کیفیت محصول مورد نیاز را نشان میدهد.
اسیدشویی فولاد
یکی از مهمترین استفادههای هیدروکلریک اسید در اسیدشویی فولاد است تا زنگ یا اکسید آهن را از روی آهن یا فولاد قبل از ورود آنها به واکنشهای بعدی مثل اکستروژن، نورد، "گالوانی کردن و دیگر تکنیکها، بزداید. HCl در کیفیت فنی با غلظت معمولاً ۱۸٪ رایجترین عامل اسیدشویی برای اسیدشویی فولادهای کربنی است.
- Fe2O3 + Fe + 6 HCl → 3 FeCl2 + 3 H2O
اسید مصرف شده استفادهٔ بسیاری در محلولهای کلرید آهن (II) (هم چنین معروف به فررو کلرید) دارد اما مقادیر بالای فلزات سنگین در مایع اسیدشویی این عملیات را با مشکل مواجه کرده است.
صنعت اسیدشویی فولاد فرآیندهای بازسازی هیدروکلریک اسید را بهبود بخشیده است، مثل فرایند بازسازی HCl سرخ کنندهٔ اسپری یا بستر سیال که بازیافت HCl را از مایع اسیدشویی مصرف شده ممکن میسازد. رایجترین فرایند بازسازی فرایند پیروهیدرولیز طی واکنش زیر است:
- 4 FeCl2 + 4 H2O + O2 → 8 HCl+ 2 Fe2O3
با بهبودی اسید مصرف شده یک حلقه اسیدی بسته ساخته میشود. فرآوردهٔ جانبی اکسید آهن (II) از واکنش بازسازی باارزش است چون در بسیاری از صنایع ثانوی به کار میرود.
تولید ترکیبات آلی
دیگر استفاده مهم هیدروکلریک اسید در تولید ترکیبات آلی، مثل وینیل کلرید و دی کلرواتان برای پلی وینیل کلراید (PVC) است. معمول این کار یک استفادهٔ غیرآزاد است زیرا مصرف محلی هیدروکلریک اسید تولید شده در واقع به بازار آزاد نمیرسد. دیگر ترکیبات آلی تولید شونده توسط هیدروکلریک اسید عبارتند از بیسفنول ای برای پلی کربنات، کربن فعال و اسید اسکوربیک مثل تولیدات متعدد داروهای شیمیایی.
- 2 CH2=CH2 + 4 HCl + O2 → 2 ClCH2CH2Cl + 2 H2O (دی کلرواتان توسط اکسی کلری شدن)
چوب + HCl + حرارت ← کربن فعال (فعال سازی شیمیایی)
تولید ترکیبات غیرآلی
محصولات زیادی توسط هیدروکلریک اسید طی یک واکنش اسید و باز طبیعی منجر به ترکیبات معدنی (غیرآلی) تولید میشوند و هم چنین مواد شیمیایی درگیر با آب مثل کلرید آهن (III) و پلی آلومینیوم کلراید (PAC).
- Fe2O3 + 6 HCl → 2 FeCl3 + 3 H2O (کلرید آهن (III) از مگنتیت)
کلرید آهن (III) و PAC هر دو بعنوان عوامل لخته سازی و انعقاد در تصفیه آب و فاضلاب، تولید آب آشامیدنی و تولید کاغذ به کار میروند. دیگر ترکیبات معدنی تولید شونده با هیدروکلریک اسید شامل کلرید کلسیم، نمک پخش در جاده، کلرید نیکل (II) برای آبکاری الکتریکی و کلرید روی برای صنعتگالوانی کردن و تولید باتری هستند.
- CaCO3 + 2 HCl → CaCl2 + CO2 + H2O (کلرید کلسیم از سنگ آهک)
کنترل pH و خنثی سازی
هیدروکلریک اسید هم چنین برای تنظیم اسیدی بودن (pH) محلولها به کار میرود.
- OH− + HCl → H2O + Cl−
در خلوص مورد نیاز صنایع (غذایی، دارویی، آب آشامیدنی)، هیدروکلریک اسید با کیفیت برای تنظیم pH فرایند جریانهای آبی مورد استفاده قرار میگیرد. در صنایع کم تقاضا، هیدروکلریک اسید با کیفیت فنی برای خنثی سازی جریانهای اتلافی و مراقبت از استخر شنا به کار گرفته میشود.
بازسازی مبدلهای یونی
هیدروکلریک اسید پر کیفیت در بازسازی یک رزین مبدل یون به کار گرفته میشود. تبادل کاتیون به طور گسترده برای حذف یونهایی مثل Na+ و Ca2+ از محلولهای آبی در تولید آب معدنی شده مورد استفاده قرار میگیرد. اسید برای شستن کاتیونها از رزینها به کار میرود. Na+ با H و Ca2+ با 2HHجایگزین میشود.
مبادله میشوند. مبدلهای یونی و آب معدنی در تمام صنایع شیمیایی، تولید آب آشامیدنی و اکثر صنایع غذایی مورد استفاده قرار میگیرند.
دیگر کاربرد های هیدروکلریک اسید
هیدروکلریک اسید در تعداد زیادی از کاربریهای مقیاس کوچک مثل فرایند چرم سازی، خالص سازی نمک طعام، نظافت و خانهداری،[۲۷] و بنای ساختمانها به کار میرود. تولید نفت را میتوان با تزریق هیدروکلریک اسید در بستر صخرهای یک چاه نفت، حل کردن یک بخش از صخره و ساختن یک منفذ بزرگ تحریک کرد. اسیدزنی چاه نفت یک فرایند معمول در صنعت تولید نفت دریای شمال است.
هیدروکلریک اسید برای حل کردن کلسیم کربنات نیز به کار میرود به عنوان مثال برای پوسته پوسته کردن کتریها و برای پاک کردن ملات از آجرکاریها. البته یک مایع خطرناک است که باید با دقت کافی از آن استفاده کرد. ضمن استفاده روی یک آجرکاری، واکنش آن با ملات تا جایی که کل اسید تبدیل شود ادامه مییابد و کلسیم کربنات، کربن دی اکسید و آب را به همراه دارد:
2HCl + CaCO3 → CaCl2 + CO2 + H2O
اکثر واکنشهای شیمیایی هیدورکلریک اسید در تولید غذا، مواد تشکیل دهنده غذا و افزودنیهای غذایی به کار گرفته میشوند. محصولات رایج عبارتند از آسپارتام، فروکتوز، سیتریک اسید، لیزین، پروتئین گیاهی هیدرولیز شده با اسید به عنوان مقوی غذایی، و در تولید ژلاتین. هیدروکلریک اسید مورد استفاده در صنایع غذایی (خیلی خالص) را میتوان موقع نیاز برای محصول نهایی به کار برد.
در سیاره زهره ابرهایی از هیدروکلریک اسید با غلظت کم وجود دارد.
حضور در موجودات زنده

اسید معده یکی از ترشحات اصلی معده است و به طور عمده شامل هیدروکلریک اسید بوده و محتوای معده را طوری اسیدی میکند که پی اچ بین ۱ و ۲ داشته باشد.[۲۸][۲۹]
یونهای کلرید (Cl−) و هیدروژن (H+) در ناحیهٔ بالایی معده توسط یاخته جداری از مخاط اسید معده ترشح میشوند و به سمت یک شبکهٔ ترشحی به نام کانالیکولی قبل از اینکه وارد حفره پایینی معده شوند، هدایت میشوند.[۳۰]
اسید معده مانند یک سد مقابل ریزاندامهها برای جلوگیری از عفونتها ظاهر میشود و برای هضم غذا اهمیت زیادی دارد. پی اچ پایین آن پروتئینها را دناتوره میکند و در نتیجه آنها را برای تخریب توسط آنزیمهای گوارشی مثل پپسین حساس میکند. پی اچ پایین هم چنین آنزیم پیشروی پپسینوژن را فعال و تبدیل به آنزیم فعال پپسین (با خودشکافی) میکند. بعد از ترک معده، هیدروکلریک اسید کیموس توسط سدیم بی کربنات در دوازدهه خنثی میشود.
خود معده با ترشح لایهٔ ضخیم مخاط، و با سکرتین ناشی از محلول بافر سدیم بی کربنات در مقابل این اسید قوی از خود محافظت میکند. سوزش یر دل یا زخم معده وقتی این مکانیزمها دچار مشکل شوند، رخ میدهند. داروهای آنتی هیستامین و دستههای مهارکنندههای پروتون پمپ میتوانند تولید اسید در معده را مهار کنند، و آنتاسیدها نیز برای خنثی تر کردن اسید موجود مورد استفاده قرار میگیرند.[۳۱]
ایمنی
| غلظت بر حسب وزن | طبقهبندی[۳۲] | کد ایمنی |
|---|---|---|
| ۱۰–۲۵٪ | محرک (Xi) | R36/37/38 |
| > ۲۵٪ | خورنده (C) | R۳۴ R۳۷ |
هیدروکلریک اسید غلیظ (هیدروکلریک اسید بخار) مههای اسیدی تشکیل میدهد. مه و محلول هر دو تأثیر خورنده بازگشت ناپذیری بر بافت انسان با قابلیت تخریب اندامهای تنفسی، چشمها، پوست و رودهها دارند. پس از اختلاط هیدروکلریک اسید بامواد شیمیایی اکسید کنندهٔ معمول مثل سدیم هیپوکلریت (سفیدکننده، NaClO) یا پتاسیم پرمنگنات (KMnO4)، گاز سمی کلر تولید میشود.
- NaClO + 2 HCl → H2O + NaCl + Cl2
- 2 KMnO4 + 16 HCl → 2 MnCl2 + 8 H2O + 2 KCl + 5 Cl2
تجهیزات ایمنی مثل دستکشهای لاستیکی یا PVC، عینکهای ایمنی محافظ چشم و کفشها و لباسهای مقاوم در برابر مواد شیمیایی برای به حداقل رساندن خطرات استفاده از هیدروکلریک اسید به کار میروند. آژانس حفاظت محیط زیست ایالات متحده آمریکا هیدروکلریک اسید را یک مادهٔ سمی معرفی کرده و مقررات آن را تنظیم مینماید.[۳۳]
شماره بینالمللی کالاهای خطرناک یا شمارهٔ وزارت ترابری آمریکا (DOT) آن ۱۷۸۹ است. این شماره روی یک پلاکارد بر روی محفظه نمایش داده میشود.
| شناساگرها | |
|---|---|
| شماره ثبت سیایاس | ۷۶۴۷–۰۱-۰ |
| شمارهٔ آرتیئیسیاس | MW4025000 |
| خصوصیات | |
| فرمول مولکولی | HCl in آب (H2O) |
| جرم مولی | 36.46 g/mol (HCl) |
| شکل ظاهری | Clear colorless to light-yellow liquid |
| چگالی | 1.18g/cm3 |
| دمای ذوب | −27.32 °C (247 K) 38% solution. |
| دمای جوش |
110 °C (383 K)
20.2% solution; 48 °C (321 K) 38% solution. |
| انحلالپذیری در آب | Miscible. |
| اسیدی (pKa) | −8.0 |
| گرانروی | 1.9 mPa·s at 25 °C 31.5% solution |
| خطرات | |
| MSDS | External MSDS |
| طبقهبندی ئییو | |
| کدهای ایمنی | R۳۵, R۳۷ |
| شمارههای نگهداری | S26, S۳۶, S45 |
| خطرات اصلی | Corrosive |
| لوزی آتش |
 0
3
1
COR
|
| نقطه اشتعال | Non-flammable. |
| ترکیبات مرتبط | |
| دیگر آنیونها | F- Br- I- |
| مرتبط با acids | هیدروبرومیک اسید هیدروفلوئوریک اسید هیدروژن یدید سولفوریک اسید |
اسید کرومیک مشخصات
اسید کرومیک (به انگلیسی: Chromic acid) یک ترکیب شیمیایی با شناسه پابکم ۲۴۴۲۵ است. شکل ظاهری این ترکیب، بلورهای قرمز است.
| شناساگرها | |
|---|---|
| شماره ثبت سیایاس | 7738-94-5 |
| پابکم | 24425 |
| کماسپایدر | 22834 |
| شمارهٔ ئیسی | 231-801-5 |
| ChEBI | CHEBI:33143 |
|
مرجع جیملین
|
25982 |
| جیمول-تصاویر سه بعدی | Image 1 Image 2 |
| خصوصیات | |
| فرمول مولکولی | H2CrO4 |
| جرم مولی | ۱۱۸٫۰۱ g mol−1 |
| شکل ظاهری | Red crystals |
| چگالی | 1.201 g cm-3 |
| دمای ذوب | ۱۹۷ درجه سلسیوس (۳۸۷ درجه فارنهایت; ۴۷۰ کلوین) |
| دمای جوش |
250 °C, 523 K, 482 °F decomposes
|
| انحلالپذیری درآب | 1666.6 g dm-3 |
استیک اسید مشخصات
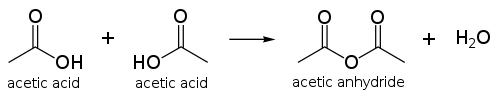
اسید استیک یا نام آیوپاک آن اتانوئیک اسید، جوهر انگور یا جوهر سرکه جز اسیدهای آلی (از گروه کربوکسیلیک اسیدها) است. فرمول آن CH3COOH است.
محتویات
۱نگاه کلی
۲نامگذاری
۳تاریخچه
۴خواص شیمیایی
۵حلال
۶واکنشهای شیمیایی
۷شناسایی
۸بیوشیمی
۹تولید
۹.۱روشهای تولید صنعتی اسید اسیتیک
۱۰کربندارکردن متانول
۱۱اکسایش استالدئید
۱۲اکسایش اتیلن
۱۳تخمیر
۱۴کاربردها
۱۵استات وینیل تکپاره
۱۶تولید استر
۱۷آنیدرید استیک
۱۸سرکه
۱۹کاربرد به عنوان حلال
۲۰سایر کاربردها
۲۱ایمنی
۲۲جستارهای وابسته
۲۳منابع
۲۴پیوند به بیرون
۲۵پانویس
نگاه کلی
اسید استیک جز اسیدهای کربوکسیلیک میباشد و در نامگذاری آیوپاک به اسید اتانوئیک معروف است. این اسید دارای فرمول شیمیایی میباشد و در قسمت چشایی طعم ترشی، شبیه طعم سرکه میدهد.
این اسید یک اسید ضعیف بوده زیرا تنها مقداری اسید جدا شده در محلول آبی می باشد. استیک اسید بدون آب و خالص (استیک اسید یخی) یک مایع بدون رنگ بوده که آب را از محیط اطرافش جذب میکند(هیگروسکوپی) و در دمای 16.5 C(62 F) به شکل یک جامد کریستالی بی رنگ منجمد می شود. اسید خالص و محلول های غلیظ آن بسیار خورنده هستند.
استیک اسید یکی از ساده ترین کربکسیلیک اسید ها است. این اسید یک معرف شیمیایی مهم بوده و یک ماده شیمیایی صنعتی مورد استفاده در تولید مواد زیر است: پلی اتیلن ترفتالات که به صورت عمده در بطری های نوشابه استفاده می شود؛ سلولوز استات که به طور عمده در فیلم عکاسی استفاده می شود؛ پلی وینیل استات برای چسب چوب به علاوه فایبر ها و فابریک های مصنوعی. در خانه، استیک اسید رقیق برای بازکردن لوله ها استفاده می شود. در صنعت غذا، استیک اسید تحت کد افزودنی E2600 به عنوان تنظیم اسیدی و به عنوان چاشنی استفاده می شود.
تقاضای جهانی استیک اسید در حدود 6.5 میلیون تون در سال (Mt/a) که حدود 1.5 Mt/a از طریق بازیافت برآورده می شود. باقی آن توسط بازار خوراک پتروشیمیایی یا منابع بیولوژیکی تولید می شود. استیک اسید رقیق تولید شده توسط تخمیر طبیعی، سرکه نامیده می شود.
باکتریهای مخمر سرکه به دلیل تمایل به تولید اسید استیک به این نام معروف شدهاند. این باکتریها در مواد غذایی، آب و خاک یافت میشوند. اسید استیک بطور طبیعی از میوهها و برخی مواد غذایی فاسد شده از فرایند تخمیر تولید میشوند و از قدیمیترین ترکیبات شیمیایی شناخته شده توسط انسان میباشد.
نامگذاری
نام «اسید استیک» رایجترین و رسمیترین نامی است که توسط IUPAC برای این ماده بکار میرود. این نام از کلمه لاتین acetum، به معنی سرکه، گرفته شدهاست. «اسید اتانوئیک» که به عنوان مترادف آن بکار میرود، یک نام سازمانیافتهاست که گاهی در معرفی نامگذاری مواد شیمیایی عنوان میشود.
«اسید استیک منجمد» یک نام سطحی برای اسید استیک بدون آب است. مثل نام آلمانی Eisessig(که به صورت تحتاللفظی به معنای سرکه یخی است)، این نام، از نام کریستالهایی برگرفته شده که در دمای اندکی زیر ۷/۱۶ درجه سانتیگراد(حدود ۶۲۲ درجه فارنهایت) شکل میگیرند.
رایجترین و رسمیترین نام اختصاری برای اسید استیک AcOH یا HOAc است که در آن Ac مخفف گروه عاملی|گروه استیل است CH۳−C(=O)−؛ در واکنشهای اسیدی، علامت اختصاری HAc بکار میرود که در آن Ac مخفف استات آنیون (CH۳COO−) میباشد، هر چند که بسیاری این نامگذاری را گمراه کننده میدانند. باید توجه داشت که در حالتی دیگر نباید Ac را با مخفف عنصر شیمیایی اکتینیم اشتباه گرفت.
فرمول ساده اسید استیک CH۲O و فرمولی مولکولی آن C۲H۴O۲ است. حالت آخر با هدف نشان دادن بهتر ساختار، بصورت CH۳-COOH, CH۳COOH، یا CH۳CO۲H نوشته میشود. یونی که در نتیجه حذف پروتون (H+) از اسید استیک به جا میماند «استات» آنیون نام دارد. همچنین نام «استات» به نمکی که حاوی این آنیون یا یک استر اسید استیک باشد اطلاق میگردد.
تاریخچه

اسید استیک منجمد
قدمت سرکه به اندازه عمر تمدن و حتی بیشتر است. اسید استیکهای باکتریزا در همه جای جهان وجود دارند و هر فرهنگی که در آن عملآوری خمر همچون آبجو یا شراب وجود داشته، به ناچار سرکه را نیز که نتیجه طبیعی تماس ایننوشیدنیهای الکلی با هوا بوده کشف کردهاند.
استفاده از اسید استیک در شیمی، به عهد باستان برمیگردد. در قرن سوم پیش از میلاد، تئوفراستوس فیلسوف یونانی|یونان تشریح کرد که سرکه چگونه بر روی فلزات اثر میکند تا از واکنش آنها رنگدانههای مورد استفاده در کارهای هنری تولید شوند که از آن جمله میتوان به «سرب سفید» (کربنات سرب) و «زنگار مس» اشاره کرد که ترکیبی سبز رنگ از نمکهای مس از جمله استات مس ۲ میباشد. رومیان باستان، شراب ترشیده را در ظرفهای سربی میجوشاندند تا از آن یک شربت بسیار شیرین با نام «ساپا» تهیه کنند. ساپا سرشار از استات سرب بود که به آن «شکر سرب» یا «شکر (افسانه)زحل میگفتند و اشراف روم آنرا در مسمومسازی با سرب بکار میگرفتند. در قرن هشتم، جابر بن حیان کیمیاگر ایرانی از طریق تقطیر اسید استیک را از سرکه جدا کرد.
در دوران رنسانس، اسید استیک منجمد از طریق تقطیر خشک استاتهای فلزی تهیه میشد. در قرن شانزدهم، آندریاس لیباویوس کیمیاگر آلمانی چنین رویهای را تشریح کرد و اسید استیک منجمد حاصل از این روش را با سرکه مقایسه کرد. وجود آب در سرکه بر ویژگیهای اسید استیک چنان تاثیر عمیقی داشت که شیمیدانها تا قرنها معتقد بودند که اسید استیک منجمد و اسیدی که در سرکه یافت میشود دو ماده مختلف هستند. پیر آدت شیمیدان فرانسوی ثابت کرد که این دو در حقیقت یکی هستند.
در سال ۱۸۴۷، هرمان کولب شیمیدان آلمانی برای اولین بار از طریق مواد معدنی موفق به ساخت اسید استیک شد. ترتیب این واکنش عبارت بود از کلردار کردن دی سولفید کربن و تبدیل آن به تترا کلراید کربن، سپس از طریق تفکافت به تتراکلورو اتیلن و از طریق کلردار کردن آبی به اسید تری کلرواستیک و در نهایت کاهش آن از طریق برقکافت به اسید استیک.
.[۲]

اسید استیک
تا سال ۱۹۱۰، اسید استیک منجمد اغلب از «تقطیر مشروبات الکلی» یا تقطیر چوب بدست میآمد. با استفاده از هیدروکسید کلسیم را جدا میکردند؛ سپس استات کلسیم به جا مانده را با استفاده از اسید سولفوریک اسیدی میکردند تا از آن اسید استیک بدست آید. در همین زمان، آلمان ۱۰٫۰۰۰ تن اسید استیک منجمد تولید میکرد که ۳۰درصد از آن برای تولید رنگ نیل استفاده میشد.[۳][۴]
خواص شیمیایی
؛ قدرت اسیدی اتم هیدروژن (H) در گروه کربوکسیل (−COOH) در اسیدهای کربوکسیلیک همچون اسید استیک، میتواند به عنوان یک یون (پروتون) H+ آزاد شود و به آنها خاصیت اسیدی دهد. اسید استیک در محلولهای آبی یک اسید تکپروتونی مؤثر است با ارزش ثابت تفکیک اسیدی(pKa) آن   ۰/ ۱ A ۸/۴; pH مولاریته محلول آن (در حدود انسجام سرکه خانگی) ۴/۲ است که نشان میدهد ۴/۰ درصد از مولکولهای اسید استیک تفکیک یافتهاند.

دی مر چرخهای اسید استیک؛ خطوط تیره نشاندهنده پیوندهای هیدروژنی هستند
ساختار کریستالی اسید استیک [۵] نشان میدهد که مولکولها به صورت دی مر جفت میشوند که پیوندهای هیدروژنی آنها را به هم متصل کردهاست. دی مرها را میتوان در بخار ۱۲۰درجه سانتی گراد شناسایی کرد. این حالت ممکن است در فاز مایع اسید استیک خالص نیز رخ دهد اما در صورت وجود آب، به سرعت به هم میریزد. سایر اسیدهای کربوکسیلیک پایینتر نیز این رفتار دیمرسازی را دارند.
حلال
اسید استیک مایع، مانند آب و اتانول یک حلال پروتوندار آبدوست (مولکول قطبی|قطبی) است. این ماده با ثابت دی الکتریک ۲/۶، میتواند علاوه بر حل کردن ترکیبات قطبی همچون نمکهای معدنی و شکرها، ترکیبات غیر قطبی همچون روغنها وعناصر شیمیایی مثل سولفور و آیودین را در خود حل کند. این ماده با بسیاری از حلالهای قطبی و غیر قطبی همچون آب، کلروفورم و هگزان مخلوط میشود. این خاصیت انحلال و امتزاجپذیری اسید استیک آنرا به یک ماده شیمیایی پرکاربرد صنعتی تبدیل کردهاست.
واکنشهای شیمیایی
اسید استیک برای بسیاری از فلزات از جمله آهن، منیزیم و روی خاصیت خورندگی دارد و در واکنش با آنها، گاز هیدروژن و نمکهای فلزی به نام استاتها تولید میکند. با قرار گرفتن آلومینیوم در معرض اکسیژن، یک لایه نازک از اکسید آلومینیوم بر روی سطح آن ایجاد میشود که نسبتاً مقاوم است. در نتیجه تانکرهای آلومینیومی در حملونقل اسید استیک مورد استفاده قرار میگیرند. استاتهای فلزی را میتوان از واکنش اسید استیک با یک باز نیز بدست آورد؛ که نمونه مشهور آن واکنش « جوش شیرین = سرکه» میباشد. به جز استات کرومیم ۲۲، تقریباً کلیه استاتها در آب قابل حل هستند.

واکنشهای شیمیایی عادی یک اسد کربوکسیلیک در مورد اسید استیک اتفاق میافتد که تشکیل اتانول از طریق کاهش و تشکیل مشتقاتی همچون کلرید استیل از طریق استخلاف هستهدوست اسیل، از موارد قابل توجه آن هستند. دیگر مشتقات استخلافی عبارتند از آنیدریدهای استیک؛ این آنیدرید از طریق از دست دادن آب در دو مولکول اسید استیک رخ میدهد. به همین ترتیب، استرهای اسید استیک میتوانند از طریق استری کردن فیشری تشکیل شوند و آمیدها نیز به همین ترتیب بوجود آیند. در صورتیکه اسید استیک در معرض حرارت بالای ۴۴۰ درجه سانتیگراد قرار گیرد، تجزیه شده و از آن دی اکسید کربن و متان یا کتن و آب تولید میشود.
شناسایی
اسید استیک را میتوان از طریق بوی خاص آن شناخت. یک واکنش رنگی برای نمکهای اسید استیک محلول کلرید آهن ۳ است که رنگ قرمز سیر ایجاد میکند که پس از اسیدیسازی ناپدید میشود استاتها وقتی با تری اکسید آرسنیک از اکسید کاکودیل حرارت داده میشوند، از طریق بوی بدی که تولید میکنند قابل شناسایی هستند.
بیوشیمی
گروه عامل|گروه استیل، که از اسید استیک مشتق شدهاند تقریباً در بیوشیمی کلیه گونههای حیات نقشی بنیادین دارند. آنها در مجاورت با کوآنزیم A به مهمترین قسمت متابولیسم کربوهیدراتها و چربیها تبدیل میشوند. در عین حال، به خاطر جلوگیری از برهم خوردن کنترل pH محتویات سلولی، تجمع اسید استیکهای آزاد در سلولها در سطوح پایین حفظ میشود. برخلاف اسیدهای کربوکسیلیک با زنجیره بلندتر(اسیدهای چرب)، اسید استیک در تری گلیسریدهای طبیعی بوجود نمیآید. در عین حال، تری گلیسیرید مصنوعی تری استین (گلیسیرین تری استات) یک افزودنی غذایی متداول است و در مواد آرایشی و داروهای موضعی بکار گرفته میشوند.
اسید استیک توسط برخی میکروبهای گیاهی تولید و دفع|مدفوع میشوند که از مهمترین آنها میتوان به دسته «بچه سرکه» و کلوستریدیم استو بیتی لیکیوم اشاره کرد. این باکتریها در همه جا در مواد غذایی، آب و خاک یافت میشوند و با گندیدن میوهها و سایر غذاها، اسید استیک بطور طبیعی تولید میشود. اسید استیک همچنین یکی از ترکیبات لیزکننده مهبلی آدمیزاد و سایر پستانداران نخستی است و در آنجا به عنوان یک عامل ضد باکتری ملایم عمل میکند.[۶]
تولید
کارخانه تصفیه و تغلیظ اسید استیک در سال 1884
اسید استیک، هم بطور مصنوعی و هم از طریق تخمیر باکتریایی، تولید میشود. امروزه روش باکتریایی تنها ۱۰ درصد از تولید را به خود اختصاص دادهاست اما به دلیل اینکه قوانین جهانی مربوط به سلامت غذا بر تهیه سرکه خوراکی از مواد بیولوژیکی تاکید میکند، این روش همچنان برای تولید سرکه استفاده میشود. تقریباً حدود ۷۵ درصد از اسید استیک تولید شده برای استفادههای صنعتی، از کربندار کردن متانول و به روشی که در زیر میآید تولید میشود. برای بقیه مصارف، از روشهای دیگر استفاده میشود.[۷]
کل تولید جهانی اسید استیک   ۵ میلیون تن در سال برآورد میشود که نیمی از آن در ایالات متحده تولید میشود. تولید این ماده در اروپا ۱ میلیون تن در سال است که میزان آن رو به کاهش نهاده؛ در ژاپن نیز تولید این ماده ۷/۰ میلیون تن در سال است. از سوی دیگر هرسالانه ۵/۱ میلیون تن اسید استیک بازیافت میشود که تولید جهانی را به ۵/۶ میلیون تن در سال میرساند.[۸][۹]
بزرگترین تولیدکنندگان اسید استیک دست نخورده، سلانس و بیپی|صنایع شیمیایی بی پی هستند. از دیگر تولیدکنندگان عمده این ماده میتوان به ملنیوم کمیکالز، استرلینگ کمیکالز، سام سونگ، ایستمن و سوونسک اتانول کمی اشاره کرد.
روشهای تولید صنعتی اسید اسیتیک
کربونیلاسیون متانول : در این روش متانول با مونوکسید کربن در فشارهای بالا (۲۰۰atm) واکنش داده و اسید استیک تولید میکند. این روش از سال ۱۹۲۰ ابداع شدهاست و به دلیل ارزان بودن متانول و از لحاظ اقتصادی مقرون به صرفهاست.
اکسیداسیون بوتان : از حرارت دادن بوتان با اکسیژن هوا در حضور یونهای فلزی منگنز، کبالت و کروم، پروکسید تولید میشود. پروکسید در اثر تجزیه اسید استیک ایجاد میکند.
{۲C_۴HiO + CO_۲ → ۴CH_۳COOH + ۲H_۲O}
اکسیداسیون استالدئید : استالدئید در شرایط ملایم و در حضور کاتالیزورهای ساده فلزی مثل منگنز و کروم و... توسط اکسیژن هوا اکسید شده و اسید استیک تولید میکند.
{۲CH_۳CHO + ۲O_۲ → ۲CH_۳COOH}
محصولات جانبی تولید شده در این واکنش مانند اسید فرمیک یا استات اتیل و... به دلیل داشتن نقطه جوش پایینتر از اسید استیک توسط تقطیر جداسازی میشوند. کاربرد اسید استیک به صورت سرکه به عنوان چاشنی غذا و تهیه انواع ترشی استفاده میشود. اسید استیک رقیق به عنوان افشانه برای از بین بردن قارچهای گیاهان استفاده میشود. اسید استیک گلاسیال در صنایع شیمیایی در تولید فیلمهای عکاسی، تولید پلاستیک پلیاتیلن تریفتالات (PETT) استفاده میشود. همچنین به عنوان ماده واسطه در تولید استات وینیل که ترکیب مهمی در تولید چسب و رنگ میباشد،
کربندارکردن متانول
بیشتر اسید استیک جهان به روش کربندار کردن متانول تولید میشود. در این فرایند، متانول و مونو اکسید کربن با یکدیگر واکنش میدهند تا بر اساس معدله شیمیایی زیر اسید استیک تولید شود:
متانول|CH۳OH+مونواکسید کربن |CO→ CH۳COOH
این فرایند که در آن یودو متان به عنوان میانجی مورد استفاده قرار میگیرد، در سه مرحله اتفاق میافتد. یک کاتالیزور که عمدتاً یک کمپلکس است برای کربندار کردن مورد استفاده نیاز است. (گام ۲)
(۱)CH۳OH+ یودید هیدروژن|HI→یودومتان|CH۳I + H۲O
(۲) CH۳I + مونواکسیدکربن |CO → CH۳COI
(۳) CH۳COI + H۲O → CH۳COOH + HI
با تغییر شرایط فرایند، میتوان در همان کارخانه آنیدرید استیک تولید کرد. از آنجاکه هم متانول و هم مونواکسیدکربن مواد خام مناسبی هستند، کربندارکردن متانول از درباز به عنوان یکی از بهترین روشها برای تولید اسید استیک به شمار میآمدهاست. در سال ۱۹۲۵، هنری درفیوس از سلانس بریتانیا یک کارخانه موازی کربندارکردن متانول را تاسیس کرد.[۱۰] با این حال نبود مواد کاربردی که بتوانند در فشارهای بالای مورد نیاز (۲۰۰۰ (واحد)اتمسفر یا بیشتر) حاوی مخلوطهای واکنشی خورنده باشند، باعث شد برای مدتی تمایل به تجاریسازی این روشها از بین برود.
اولین فرایند تجاری کربندارکردن متانول که در آن از کوبالت به عنوان کاتالیزور استفاده میشد، در سال ۱۹۶۳ توسط شرکت صنایع شیمیایی BASF انجام گرفت. در سال ۱۹۶۸، یک کاتالیزور رودیومی (cis−[Rh(CO)۲I۲]−) که میتوانست در فشارهای پایین بدون تولید هیچ فراورده جانبی عمل کند کشف شد. اولین کارخانهای که از این روش استفاده کرد، در سال ۱۹۷۰ توسط شرکت صنایع شیمیایی مونسانتو آمریکا ساخته شد و از آن پس، کربندارکردن متانول با کاتالیزور رودیومی به روش غالب در تولید اسید استیک تبدیل شد. (همچنین رجوع کنید به فرایند مونساتو). در اواخر دهه نود، شرکت صنایع شیمیایی بیپی استفاده تجاری از کاتالیزور کاتیوا ([Ir(CO)۲I۲]−) را که بوسیله روتنیم ارتقا یافته بود آغاز کرد. این فرایند که کاتالیزور آن ایریدیوم است طبیعتدوستتر و کارآمدتر است[۱۱] و تا حد زیادی جای فرایند مونسانتو را در همان کارخانه گرفتهاست.
اکسایش استالدئید
پیش از تجاری شدن روش مونسانتو، بیشتر اسید استیک از طریق اکسایش استالدئید تولید میشد. این روش به عنوان دومین روش مهم تولید پابرجا ماندهاست، هر چند که کربندارکردن متانول در آن، چندان مقرون به صرفه نیست. استالدئید را میتوان از طریق اکسایش بوتان یا نفتا یا آبدار کردن اتیلن بدست آورد.
وقتی بوتان یا نفتای سبک در مجاورت یونهای مختلف فلزی از جمله یونهای منگنز، کوبالت، کرومیوم، پروکسید حرارت میبینند تجزیه میشوند تا براساس معادله شیمیایی زیر اسید استیک تولید کنند.
۲ بوتان|C۴H۱۰ + ۵ اکسیژن|O۲ → ۴ CH۳COOH + ۲ آب|H۲O
معمولاً، این واکنش در تلفیقی از حرارت و فشاری انجام میشود که در عین نگهداری بوتان در حالت مایع، دما را تا حد ممکن بالا نگه دارد. شرایط واکنشی معمولاً در دمای ۱۵۰ درجه سانتیگراد و فشار  ؛ اتمسفر ۵۵ قرار دارد. ممکن است در این میان چند فراورده جانبی نیز تولید شوند از جمله بوتانون، استات اتیل، اسید فورمیک و اسید پروپونیک. این فراوردههای جانبی از لحاظ تجاری با ارزش هستند و در صورتیکه از لحاظ اقتصادی مورد نیاز باشند، شرایط واکنش را تغییر می.دهند تا مقادیر بیشتری از این فراوردهها بدست آید. در عین حال جداسازی اسید استیک از این فراوردههای جانبی ممکن است هزینههای فرایند را افزایش دهد.
تحت شرایط مشابه و با استفاده از کاتالیزورهای یکسان، همانگونه که در اکسایش بوتان صورت میگیرد، میتوان در هوا، استالدئید را برای تولید اسید استیک، توسط اکسیژن اکسید کرد.
۲ استالدئید|CH۳CHO + اکسیژن|O۲ → ۲ CH۳COOH
با استفاده از کاتالیزورهای جدید، میتوان از این واکنش بیش از ۹۵ درصد اسید استیک بدست آورد. فراوردههای جانبی این واکنش عبارتند از استات اتیل، اسید فورمیک و فورمالدئید که همه آنها نسبت به اسید استیک نقطه جوش پایینتری داشته و به راحتی میتوان از طریق تقطیر آنها را جداسازی کرد.
اکسایش اتیلن
تخمیر
؛ تخمیر اکسایشی
در بیشتر تاریخ بشری، اسید استیک در حالت سرکه، توسط گروه باکتریایی «بچه سرکه» ساخته میشدهاست. درصورت وجود اکسیژن کافی، این باکتری میتواند از انواع مختلف مواد غذایی الکلدار، سرکه تولید کند. شاخصترین این غذاها عبارتند از آب سیب، شراب و مخمر غلات|حبوبات، مالت، برنج، یا مالت سیبزمینی. کلیت واکنش شیمیاییای که توسط این باکتری تسهیل میشود عبارتست از
اتانول|C۲H۵OH + اکسیژن|O۲ → CH۳COOH + آب|H۲O
محلول رقیق الکل که با «مخمر سرکه» آغشته شده باشد، در یک محیط گرم هوادار، طی چند ماه به سرکه تبدیل میشود. روشهای صنعتی تولید سرکه، با افزایش تامین اکسیژن برای باکتری، این فرایند را تسریع میکنند.
احتمالاً اولین سرکهها، در پی اشتباه در فرایند شرابگیری تولید شدهاند. اگر فراین تخمیر در حرارت بالا انجام گیرد، بچه سرکه بطور طبیعی مخمر انگور را میپوشاند. با افزایش تقاضای سرکه برای مصارف آشپزی، پزشکی و بهداشتی، شرابفروشان خیلی سریع یاد گرفتند تا چگونه در ماههای گرم پیش از آنکه انگورها برای تبدیل به شراب به اندازه کافی برسند، سایر مواد آلی را برای تولید سرکه مورد استفاده قرار دهند. از آنجا که شرابفروشان از چگونگی این فرایند آگاهی لازم را نداشتند، این روش کند و گاهی ناموفق بود.
یکی از اولین روشهای مدرن «روش سریع» یا «روش آلمانی» است که برای اولین بار در سال ۱۸۲۳ در آلمان بکار گرفته شد. در این فرایند، تخمیر در یک برج بستهبندی شده با تراشههای چوب یا زغال چوب صورت میگیرد. غذای الکلدار از بالای برج پاشیده میشود و اتمسفر زمین|هوای تازه یا بطور طبیعی یا بصورت تبادل حرارت اجباری از پایین تامین میشود. در این فرایند، تامین بهتر هوا، زمان تهیه سرکه را از چند ماه به چند هفته کاهش میدهد.
امروزه بیشتر سرکهها در تانکرهای کشت میکروبیولوژیکی|کشت که در زیر آب غوطهور هستند تهیه میشوند. این روش برای اولین بار در سال ۱۹۴۹ توسط اوتو هروماتکا و هنریخ ابنر ابداع شد. در این روش، الکل در یک تانکر که بطور مداوم محتویات آن به هم میخورد، به سرکه تخمیر میشود و اکسیژن نیز از طریق عبور حبابهای هوا از درون محلول تامین میشود.
؛ تخمیر بدون اکسیژن
برخی گونههای باکتریهای بیهوازی از جمله چندین نوع از دسته «کلاستریدیوم» قادرند بطور مستقیم و بدون استفاده از اتانول به عنوان میانجی، شکرها را به اسید استیک تبدیل کنند. کلیت واکنش شیمیایی که توسط این باکتری انجام میشود عبارتست از:
گلوکوز|C۶H۱۲O۶ → ۳ CH۳COOH
جالبتر اینکه، از نظر شیمیدانان صنعتی، این باکتریهای بیهوازی| بیهوازیها میتوانند اسید استیک را از ترکیبات تک کربنی نظیر متانول، مونواکسیدکربن یا مخلوط دیاکسید کربن و هیدروژن تولید کنند:
۲دیاکسید کربن |CO۲+۴هیدروژن|H۲→ CH۳COOH + ۲ آب|H۲O
توانایی «کلوستریدیوم» در بهکارگیری مستقیم شکر، یا تولید اسید استیک از مواد کم هزینهتر بدین معناست که این نوع از باکتری بطور بالقوه میتواند نسبت به اکسایندگان اتانول نظیر «بچه سرکه»، در تولید اسید استیک کارآمدتر باشد. با این حال، باکتری «کلاستریدیوم» نسبت به «بچه سرکه» در مقابل اسید مقاومت کمتری دارد. حتی در مقایسه با برخی انواع بچه سرکه که میتوانند با غلط ۲۰ درصدی اسید استیک سرکه تولید کنند، مقاومترین انواع «کلاستریدیوم» تنها میتوانند چند درصد اسید استیک در سرکه تولید کنند. در حال حاضر برای تولید سرکه، استفاده از «بچه سرکه» نسبت به استفاده از «کلاستریدیوم» و سپس تغلیظ آن، مقرون به صرفهتر است. در نتیجه با وجودی که باکتریهای استوژنیک از سال ۱۹۴۰ کشف شدهاند استفاده صنعتی از آنها به تعدادی کاربرد بی خطر محدود شدهاست.
کاربردها

بطری 5/2 لیتری اسید استیک در آزمایشگاه
تولید بسیاری از بسیاری از ترکیبات شیمیایی، اسید استیک به عنوان یک واکنشگر شیمیایی به کار میآید. مهمترین کاربرد خاص اسید استیک در تولید استات وینیل تکپاره است، که بلافاصله پس از آن آنیدرید استیک و استر تولید میشود. میزان اسید استیک مورد استفاده در سرکه به نسبت اندک است.
استات وینیل تکپاره
کاربرد اصلی اسید استیک در تولید استات وینیل تکپاره (VAM) است. بین ۴۰ تا ۴۵ درصد از اسید استیک تولید شده در جهان، به مصرف این کاربرد میرسد. این واکنش که کاتالیزور آن پالادیوم است، اتیلن، اسید استیک و اکسیژن تولید میکند.
۲ H۳C-COOH + ۲ اتیلن|C۲H۴ + اکسیژن|O۲ → ۲ استات وینیل |H۳C-CO-O-CH=CH۲ + ۲ آب (مولکول)|H۲O
استات وینیل میتواند به استات پلی وینیل یا سایر پولیمرها، پولیمریزه شود که این مواد در رنگها و چسبها کاربرد دارند.
تولید استر
مهمترین استرهای اسید استیک در تولید جوهر و رنگ و پوشش استفاده می شوند. استرها شامل انیل استات و نرمال بوتیل استات و ایزو بوتیل استات و پروپیل استات می شوند. آنها معمولاً توسط واکنش کاتالیستی ار اسید استیک و الکل تولید می شوند.
بیشتر استرهای استات، از استالدهید با استفاده از واکنش تیشچنکو تولید می شود. علاوه بر این، استات ها اتر به عنوان حلال برای نیترو سلولز، لاک اکریلیک، لاک الکل زدن به جداکننده ها و لکه های چوب استفاده می شود. اول، مونومرهای گلیکول از اتیلن اکسید یا اکسید پروپیلن با الکل تولید می شوند، که سپس با اسید استیک استری می گردند. سه محصول عمده عبارتند از اتیلن گلیکول اتر استات (EEA)، اتیلن گلیکول مونو بوتیل اتر استات (EBA)، و پروپیلن گلیکول مونو متیل اتر استات، معمولتر به عنوان PGMEA در فرایند تولید نیمه هادی، جایی که آن را به عنوان مقاومت در برابر حلال مورد استفاده شناخته شده است . این مصرف حدود 15 ٪ تا 20 ٪ از اسید استیک در سراسر جهان را شامل می شود. اتر استات ها به عنوان مثال EEA، نشان داده شده است به عنوان عوامل مضر برای تولید مثل انسان است.
آنیدرید استیک
محصول مایعسازی دو مولکول اسید استیکآنیدرید استیک است. تولید جهانی آنیدرید استیک اصلیترین کاربرد است که بین ۲۰ تا ۳۰ درصد از تولید اسید استیک در جهان را به مصرف خود میرساند. آنیدرید استیک را میتوان بطور مستقیم از #کربندار کردن متانول|کربندار کردن متانول در مجاورت اسید تولید کرد و میتوان کارخانههای کاتیوا| فرایند کاتیوا را برای تولید آنیدرید تطبیق داد.
آنیدرید استیک، یک عامل قوی اسیددار کردن است. با داشتن چنین خاصیتی، کاربرد اصلی آن در تولید [ترموپلاستیک سلولزی است که به عنوان یک بافت مصنوعی در فیلم عکاسی بکار میرود. همچنین آنیدرید اسید در تولید آسپرین، هرویین و سایر ترکیبات به عنوان واکنشگر عمل میکند.
سرکه
نوشتار اصلی: سرکه
در حالت سرکه و نیز در نمکسود کردن سایر سبزیجات، محلولهای اسید استیکی (معمولاً ۵ تا ۱۸ درصد اسید استیک، با درصدی که معمولاً بر حسب جرم محاسبه میشود) بطور مستقیم به عنوان یک چاشنی مورد استفاده قرار میگیرند. سرکه خانگی اغلب رقیقتر است (۵ تا ۸ درصد اسید استیک)، ولی در نمکسود کردن غذاها برای مصارف تجاری، محلولهای غلیظ تری مورد استفاده قرار میگیرد. میزان اسید استیکی که در سطح جهانی برای تولید سرکه مورد استفاده قرار میگیرد زیاد نیست اما از دیر باز این ماده یکی از پر کاربردترین مواد در تولید سرکه بودهاست.
کاربرد به عنوان حلال
همانگونه که گفته شد اسید استیک# خواص شیمیایی|بالا، اسید استیک منجمد یک حلال پروتوندار قطبی بسیار عالی است. این ماده اغلب در تصفیه مواد آلی به عنوان حلال کریستالسازی مجدد بکار میرود. اسید استیک ذوب شده خالص در تولید اسید ترفتالیک که ماده خام پلی اتیلنترفتالیک (PET)است، به عنوان حلال بکار میرود. اگر چه در حال حاضر این کاربرد ۵ تا ۱۰ درصد از اسید استیک تولید شده در جهان را مصرف میکند، با افزایش تولید PETT انتظار میرود این کاربرد افزایش بیشتری پیدا کند.
در واکنشهایی همچون فریدل کرافتس# اکلیلدار کردن فریدل کرافتس| اکلیلدار کردن فریدل کرافتس که در آنها کربوکاتیون وجود دارد، اسید استیک به عنوان یک حلال بکار میرود. به عنوان مثال، یک مرحله از تولید تجاری کافور مصنوعی، شامل نوآرایی ونگر میروین کمفین به استات ایزوبورنیل است؛ در این حالت اسید استیک برای حفظ کربندار کردن واکنش نوآرایی|بازآراسته، هم به عنوان حلال و هم به عنوان یک هسته دوست عمل میکند. در هنگام کاهش|اکسایش یک گروه نیترو آریل به یک آنیلین با استفاده از پالادیوم کربنی، اسید استیک به عنوان حلال انتخابی استفاده میشود.
در شیمی تحلیلی، اسید استیک منجمد برای تخمین مواد قلیایی ضعیف همچون آمیدهای آلی بکار میرود. اسید استیک منجمد به عنوان باز (شیمی)| باز از آب هم ضعیفتر است در نتیجه در این میانجی، آمید به عنوان یک باز قوی عمل میکند. سپس با استفاده از یک محلول در اسید استیک منجمد با خاصیت اسیدی بسیار قوی همچون اسید پرکلورید، میتوان عیار آنرا اندازه گرفت.
سایر کاربردها
محلولهای رقیق اسید استیک، همچنین به خاطر خاصیت اسیدی ملایم آنها، مورد استفاده قرار میگیرند. در محیط خانگی، استفاده در آبگونه اسیدی ظهور فیلم و برداشتن جرم شیرآب و کتری از نمونههای آن است. خاصیت اسیدی همچنین از طریق سلولهای نیش ستاره دریایی، در درمان نیشستاره دریایی جعبهای استفاده میشود که این کار از آسیبهای جدی و یا حتی مرگ جلوگیری میکند. این خاصیت همچنین در درمان افراد مبتلا به آماس گوش| عفونت گوش خارجی به کار می.رود. همچنین در سیلوی خوراک دام، برای جلوگیری از رشد باکتریها و قارچها، بصورت افشانه از اسید استیک استفاده میشود. محلولهای رقیق اسید استیک می تواند در آزمایشگاه بالینی برای تشخیص تعداد گلبولهای قرمز و سفید استفاده شوند. یکی دیگر از استفاده های بالینی برای lysingg سلول های قرمز خون است، که می تواند ترکیبات مهم دیگر در ادرار را در هنگام آزمایش میکروسکوپی شناسایی کند. اسیدیته آن همچنین برای درمان نیش عروس دریایی کاربرد دارد و اگر فوراً استفاده شود از جراحات حاد و حتی مرگ جلو گیری می کند. و برای درمان عفونت گوش خارجی استفاده می شود. در این روش، اسید استیک به صورت افشانه بر برای علوفه دام به عنوان نگهدارنده افشانده می شود، تا رشد باکتری و قارچ تضعیف شود. اسید استیک آبی همچنین به عنوان یک حذف کننده زگیل و گندمه استفاده می شود از اسید استیک چندین نمک آلی و غیر آلی تولید میشود، از جمله:
استات سدیم__ در صنعت نساجی و نیز به عنوان نگهدارنده غذایی (E number|E۲۶۲).
استات مس ۲__ به عنوان رنگدانه و قراچکش
استات آلومینیوم و استات آهن ۲__ به عنوان ثابتکننده رنگ
استات پلادیوم ۲__ به عنوان کاتالیزور در واکنشهای جفتساز، همچون واکنش هک
استات نقره در حشره کشها
کنترل و از بین بردن کنه واروا در زنبور عسل
اسید استیکهای جایگزین تولید شده عبارتند از:
اسید مونوکلرواستیک. MCA، اسید دیکلرو استیک (به عنوان محصول فرعی) و تری کلرواستیک. MCA در تولید رنگ نیل استفاده میشود.
اسید برومو استیک، که برای تولید واکنشگر برومو استات اتیل استری میشود.
اسید تری فلوئورواستیک که در ترکیبات عالی، یک واکنشگر رایج است.
مقادیر اسید استیکی که در سایر کاربردها بکار میرود (بجز TPA)، ۵ تا ۱۰ درصد از اسید استیک مورد استفاده درسطح جهان را به خود اختصاص دادهاست. در عین حال، انتظار نمیرود این کاربردها به اندازه تولیدTPA، رشد کند.
ایمنی
اسید استیک غلیظ خورندهاست و در نتیجه باید با احتیاط با آن کار کرد، زیرا باعث سوختگی، آسیبهای دائم چشمی و سوزش اعضای دارای مایعات مخاطی میشود. این تاولها و آبلهها ممکن است تا چند ساعت پس از در معرض قرار گرفتن پدیدار نشوند. به هنگام کار کردن با این ترکیبها باید از دستکشهای مقاوم از جنس پلاستیک نیتریل استفاده کرد چراکه استفاده از دستکشهای لاتکس از ایمنی لازم برخوردار نیست. اسید استیک غلیظ در شرایط آزمایشگاهی به سختی مشتعل میشود. با بالا رفتن دما از مرز ۳۹ درجه سانتیگراد، ریسک تبدیل شدن آن به یک ماده منفجره در مجاورت هوا افزایش مییابد. (حد انفجار: ۴/۵ درصد تا ۱۶۶ درصد).
خطر محلولهای اسید استیک به میزان غلظت آن بستگی دارد. محلولهایی که اسید استیک آنها بیش از ۲۵ درصد است، به خاطر بوی زننده و بخار خورنده آنها در هود بخار نگهداری میشود. اسید استیک رقیق به شکل سرکه بی ضرر است. با اینحال وارد کردن محلولهای قویتر در آن، برای انسان و حیوانات ضرر دارد. این محلول به سیستم گوارش آسیب زده و تغییری مهلک را در خاصیت اسیدی خون ایجاد میکند.
به دلیل عدم تطبیق آن، پیشنهاد می شود که اسید استیک را از اسید کرومیک و اتیلن گلایکول و اسید نیتریک و اسید پر کلریک و پرمنگنات ها و پر اکسید ها و هیدروکسیل ها دور نگه دارید.
جستارهای وابسته
سرکه
نمکسود کردن، روشی برای نگهداری غذا
باکتری اسید استیک، تولید سرکه از محلولهای الکلی
اسید استیک (صفحه دادهها)
بچه سرکه، یک دسته مهم از باکتریهای اسید استیک
عامل پوستهزدایی، اغلب حاوی اسید استیک
؛ شیمی
مواد شیمیایی معمولی، محل خرید مواد شیمیایی مورد استفاده در آزمایشها
اسید کربوکسیلیک، هستند-COOH ترکیباتی که حاوی گروه
اسید چرب، زنجیره مستقیم اسید کربوکسیلیک * استات آنیون، CH۳COO−، بطر خلاصه ‘’AcO−’’
گروه استیل، گروه CH۳-CO–، بطور خلاصهAc
کوآنزیم استیلA، یک حامل مهم استیل در سلولها
؛ مواد شیمیایی مرتبط
اسید فورمیک، اسید کربوکسیلیک با یک اتم کربن کمتر به ازای هر مولکول
اسید پروپیونیک، اسید کربوکسیلیک با یک اتم کربن بیشتر به ازای هر مولکول
اتانول، اتیل الکل
استالدئید
استیک آنیدرید
استات اتیل، یک حلال مهم
اسید مونو کلرو استیک
اسیدهای کلرواستیک
پرمنگنات پتاسیم
تاسیم پرمنگنات ترکیبی معدنی است با فرمول شیمیایی KMnO۴. نمک آن از یونهای K+ و MnO۴- تشکیل شده است. سابقاً به آن پرمنگنات و پتاش هم میگفتند. پرمنگنات یک مادهٔ اکسندهٔ بسیار قوی است. در آب نیز محلول است و محلولی به رنگ ارغوانی تولید میکند که از تبخیر آن بلورهای منشوری و درخشان به رنگ ارغوانی بسیار تیره (مایل به سیاه) بر جای می ماند. در این ترکیب منگنز با عدد اکسایش ۷+ حضور دارد. توجه: این ماده با گلیسرین واکنش شدیدی میدهد،هیچگاه این دو ماده را کنار هم انبار نکرده و روی یک دیگر نریزید.
محلولی از پتاسیم پرمنگنات در آب درون بالن حجمی
محتویات
۱ساختار و تهیه
۲کاربردها
۲.۱صنایع سینمایی و تلویزیونی
۲.۲تصفیهٔ آب و ضدعفونی
۲.۳کاربردهای زیست پزشکی
۲.۴سنتزهای شیمی آلی
۲.۵تصفیه پسابهای صنعتی
۲.۶عیارسنجی در شیمی تجزیه
ساختار و تهیه
از بلورهایی به شکل اورتورومبیک تشکیل شده که در آن a=910.۵pm و b=572.۰pm و c=742.۵pm است. (a و b و c به ترتیب طول، عرض و ارتفاع دستگاه بلوری اورتورومبیک است.)
همچنین طول پیوند Mn-O در این پیوند برابر ۱۶۲.۹pm است.
تهیهٔ صنعتی پتاسیم پرمنگنات از منگنز دی اکسید است، که خود از سنگ معدن پیرولوسیت به دست می آید. در این روش MnO۲ به دست آمده از پیرولوسیت با پتاسیم هیدروکسید مخلوط شده و در هوا یا در مجاورت پتاسیم نیترات (یک منبع اکسیژن) حرارت داده می شود. در این فرایند پتاسیم منگنات (K۲MnO۴) به دست می آید که در اکسایش الکترولیتی (الکترولیز) در محلول بازی به پتاسیم پر منگنات تبدیل می شود.
| 2 MnO2 + 4 KOH + O2 → 2 K2MnO4 + 2 H2O |
| 2 MnO42– + Cl2 → 2 MnO4– + 2 Cl– |
همچنین پرمنگنات را می توان از اثر دادن سرب دی اکسید (PbO۲) و یا سدیم بیسموتات (NaBiO۳) بر محلول +Mn۲ نیز به دست آورد. از رنگ بنفش روشن حاصل از این واکنش برای تست حضور یا عدم حضور منگنز نیز استفاده می شود.
کاربردها
بسیاری از کاربردهای پتاسیم پرمنگنات بهخاطر خواص اکسیدکنندگی آن است، از اینکه یک اکسید کنندهٔ قوی است و اینکه در این فرایندها محصول فرعی سمی تولید نمیکند. از کاربرد های پرمنگنات پتاسیم می توان به جذب اتیلن اشاره نمود که در پس از برداشت محصولات کشاورزی جهت افزایش عمر انبار مانی می توان اشاره نمود.
صنایع سینمایی و تلویزیونی
در صنایع سینمایی و تلویزیونی، پتاسیم پرمنگنات یکی از مواد شیمیایی اصلی برای کهنه کردن مجموعهٔ لباسها و غیره می باشد. خاصیت اکسید کنندگی پرمنگنات باعث میشود که پارچه ها، طناب ها، چوبها و شیشهها بیش از ۱۰۰ سال قدیمی تر از آنچه هستند به نظر بیایند.
از این روش در تهیهٔ فیلمهایی همچون "تروی"و "ایندیانا جونز" استفاده شده است.
تصفیهٔ آب و ضدعفونی
به عنوان یک اکسید کننده، پتاسیم پرمنگنات میتواند به عنوان یک ضد عفونی کننده به کار رود. برای مثال محلول رقیق پرمنگنات برای درمان برخی زخمها مانند عفونت قارچی پا استفاده میشود.
کاربرد دیگر آن حذف آهن و هیدروژن سولفید (مادهٔ حاصل بوی بد تخم مرغ فاسد شده) و حذف فسفر آب آشامیدنیاست.
کاربردهای زیست پزشکی
همانطور که از KMnO۴ برای ضد عفونی کردن آب استفاده می شود، این نمک به طور تخصصی به عنوان ضد عفونی کننده برای درمان برخی بیماریهای انسان و حیوان نیز استفاده می شود. در بافتشناسی از آن برای سفید کردن ملانین استفاده میشود تا جزئیات بافت تیره رنگ ملانین آشکار شود. از پتاسیم پر منگنات می توان برای متفاوت کردن آمیلوئیدAA از دیگر آمیلوئیدها هم استفاده کرد. (آمیلوئیدها نوعی از پروتئینها هستند که در صورت تجمع بی جا باعث بیماریآمیلوئیدوز می شوند، برای اطلاعات بیشتر واژهٔ Amyloid را در ویکیپدیای انگلیسی ببینید) پتاسیم پرمنگنات باعث میشود که آمیلوئیدAA به وسیلهٔ رنگ سرخ کنگو (congo redd) رنگ آمیزی نشود، این در حالی است که دیگر آمیلوئیدها به وسیلهٔ سرخ کنگو رنگ می شوند. در یک بازهٔ زمانی از پتاسیم پرمنگنات برای درمان سوزاک استفاده شد و همچنین از آن هنوز در درمان برفک استفاده می شود.
سنتزهای شیمی آلی
مهمترین و بزرگترین کاربردهای پتاسیم پرمنگنات، استفاده از آن به عنوان واکنشگر در سنتز برخی مواد آلی بروش اکسایش است. مثلاً ترکیباتی بنزوآلکیل به اسیدها اکسید می شوند. همچنین بهوسیله پرمنگنات آلکنها را به گلیکولها تبدیل میکنند.
تصفیه پسابهای صنعتی
بهدلیل خاصیت اکسیدکنندگی قوی و قیمت ارزان، در تصفیه پسابهای صنعتی است.
عیارسنجی در شیمی تجزیه
یکی از روشهای مرسوم در تعیین غلظت مواد در صنعت عیارسنجی یا تیتراسیون است. عیارسنجی ها خود بر چند قسم چون پیچیده سنجی و اکسایش - کاهش هست. در عیارسنجی های اکسایش - کاهش یکی از معرفهای پرکاربرد پرمنگنات است که بهدلیل رنگ بنفش خود، نیاز به شناساگر هم ندارد. از این ترکیب برای عیارسنجی ترکیبهایی چون آب اکسیژنه و آهن (II) استفاده میشود.