نمایش موارد بر اساس برچسب: مشخصات مواد
مشخصات کتراک، (katrak ).
نام شیمیایی : کتراک، (katrak ).
اسامی مترادف با کتراک : ماده منبسط شونده غیر انفجاری ، تخریب کننده سنگ ، تخریب کننده بتن ، تخریب بتن ، تخریب ساروج ، ضد بتن .
گرید محصول : کتراک صنعتی.
شکل ظاهری : پودر سفید رنگ.
حلالیت در آب : قابل حل در آب می باشد.
مزايا استفاده از پودرهاي منبسط شونده :
1. عدم نياز به استفاده از مواد ناريه : از آنجايي كه بسياري از معادن و يا سازه هاي بتوني زائد و قابل تخريب، در مجاورت مناطق مسكوني جاده ها و يا خطوط تاسيساتي آب و برق نفت قرار دارند، براي رعايت شرايط ايمني امكان استفاده از مواد ناريه وجود ندارد به همين دليل باعث شده كه اين معادن به طور دست نخورده باقي بمانند و يا بهره برداري از آنها با ظرفيت پايين انجام شود. استفاده از پودرهاي منبسط شونده مي تواند تا حد زيادي به امر استخراج و برش قطعات سنگي و بتني كمك نمايد. ضمناً چون استفاده از مواد ناريه در ايران از نظر امنيتي مستلزم رعايت شرايط خاص مي باشد، به همين خاطر رعايت اين شرايط زمان و هزينه بسيار زيادي صرف مي شود، لذا بسياري از افراد ترجيح مي دهند از مواد جايگزين ديگري به جاي مواد ناريه استفاده كنند.
2. سهولت استفاده : استفاده از پودرهاي منبسط شونده نياز به نيروي متخصص ندارد و با يك آموزش كوتاه مدت مي توان از اين پودرها استفاده کرد.
3. سهولت حمل ونقل : پودرهاي منبسط شونده داراي بسته بندي مخصوصي بوده و به آساني قابل حمل و نقل هستند و در محل مصرف آماده سازي و مصرف مي شوند.
4. انعطاف پذيري شكل برش : معمولاً در انجام عمليات آتشباري شكل برش چندان دلخواه نيست و با كم و زياد كردن ميزان مواد ناريه و نوع آن، شكل برش از حالت دلخواه خارج مي گردد. اين مسئله به خصوص در معادن سنگ داراي اهميت زيادي است. از آنجايي كه در هنگام استفاده از پودرهاي منبسط شونده، چالها در راستاي برش دلخواه حفر مي شوند و همواره شكست در راستاي چالهاي حفاري شده رخ مي دهد. لذا مي توان به سادگي به سطح برش مطلوب دست يافت
5. سازگاري با محيط زيست : به طور كلي پودرهاي منبسط شونده تركيباتي از مواد معدني طبيعي مي باشند. كه استفاده ازآنها مشكل خاصي را از نظر زيست محيطي به وجود نمي آورد.
ماده شيميايي کتراک در اثر اختلاط با آب جهت انجام عمليات تخريبي به کار مي رود. که براي اين اختلاط توجه به نکاتي ضروري مي باشد.
طریقه استفاده کتراک
1. نسبت اختلاط کتراک با آب حدود 3 به 1 مي باشد یعنی به ازای 3 کیلوگرم پودر کتراک یک لیتر آب می ریزیم.
2. اختلاط مي بايست در ظروف پلاستيکي تميز صورت گيرد.
3. آب مورد نظر بايستي خالص بوده و املاحي نظير ca و mg نداشته باشد.
4. درجه حرارت آب براي اختلاط مي بايست بين 15 تا 20 درجه سانتي گراد باشد.
طراحي چالها :
فاصله بين چالها بايستي بر طبق الگويي رعايت شود. فرمول تجربي که در اجرا عموما جهت طراحي فواصل چالها استفاده مي شود به صورت زير مي باشد.
10 * قطر چال = حداکثر فاصله چالها ( ميلي متر )
در حاليکه به صورت تئوريک و در کاتالوگ هاي مختلف جداول گوناگوني وجود دارد که از آنها مي توان جهت تعيين ضرايب مورد استفاده در فرمول محاسبه فواصل چالها، در اين روش استفاده کرد. فرمول به صورت زير مي باشد :
ضريب * قطر چال = حداکثر فاصله چالها ( ميلي متر )
ضريب مورد نظر در فرمول بالا را مي توان از طريق جداول مخصوصي که براي تعيين مقدار اين ضريب تهيه شده است، استفاده کرد. جدول تعيين ضرايب بر اساس داده هاي تجربي در سر معادن بدست آمده است.
جدول تعيين ضرايب جهت طراحي فواصل چال :
چگونگي استفاده ازكتراك :
کتراک را ابتدا با نسبت 3 به 1 با آب خالص مخلوط كرده، سپس دوغاب حاصله را به مقدار معين ، تا 80% ارتفاع چال پر مي كنيم. سپس سرچال را با گوه چوبي مي كوبيم تا در چال بسته شود. سپس پس از نیم ساعت از ريختن کتراک در داخل چال، فعل و انفعالات شيميايي انجام مي گيرد وتوليد گاز مي كند. در اثر فشار گاز گوه چوبي مقداري به سمت بالا حركت مي كند. لازم به ذكر است كه بايستي دقت شود تا نیم ساعت پس از ريختن دوغاب در داخل چال مجدداً پتك ها را در داخل چال بكوبيم. براي اينكه كتراك عمل شكستن را به طور كامل انجام دهد بايستي 1 تا 2 ساعت به آن فرصت داده شود. این زمان بستگی به سختی سنگ دارد.
سیانید سدیم مشخصات
سدیم سیانید (به انگلیسی: Sodium cyanide) با فرمول شیمیایی NaCN یک ترکیب شیمیایی با شناسه پابکم ۸۹۲۹ است. که جرم مولی آن ۴۹٫۰۰۷۲ g/mol میباشد. شکل ظاهری این ترکیب، جامد سفید است.
| Sodium cyanide | |||
|---|---|---|---|
|
|||
| شناساگرها | |||
| شماره ثبت سیایاس | 143-33-9 |
||
| پابکم | 8929 | ||
| کماسپایدر | 8587 |
||
| شمارهٔ ئیسی | 205-599-4 | ||
| شمارهٔ یواِن | 1689 | ||
| ChEMBL | CHEMBL1644697 |
||
| شمارهٔ آرتیئیسیاس | VZ7525000 | ||
| جیمول-تصاویر سه بعدی | Image 1 | ||
| خصوصیات | |||
| فرمول مولکولی | NaCN | ||
| جرم مولی | 49.0072 g/mol | ||
| شکل ظاهری | white solid | ||
| بوی | faint almond-like | ||
| چگالی | 1.5955 g/cm3 | ||
| دمای ذوب | ۵۶۳٫۷ درجه سلسیوس (۱٬۰۴۶٫۷ درجه فارنهایت; ۸۳۶٫۹ کلوین) | ||
| دمای جوش |
1496 °C, 1769 K, 2725 °F
|
||
| انحلالپذیری در آب | 48.15 g/100 mL (10 °C) 63.7 g/100 mL (25 °C) |
||
| انحلالپذیری | soluble in ammoniamethanol ethanol very slightly soluble in dimethylformamide SO2 insoluble in dimethylsulphoxide |
||
| ضریب شکست (nD) | 1.452 | ||
| ترموشیمی | |||
|
ظرفیت گرمایی
ویژه C |
70.4 J/mol K | ||
|
آنتروپی مولار
استاندارد S |
115.7 J/mol K | ||
|
آنتالپی استاندارد
تشکیل ΔfH |
-91 kJ/mol | ||
| خطرات | |||
| طبقهبندی ئییو | |||
| کدهای ایمنی | R26/27/28, R32, R50/53 | ||
| شمارههای نگهداری | (S1/2), S۷, S۲۸, S۲۹, S45,S60, S61 | ||
| لوزی آتش |
 0
4
0
|
||
| نقطه اشتعال | Non-flammable | ||
| آمریکا Permissible exposure limit (PEL) |
TWA 5 mg/m3[۲] | ||
| LD50 | 6.44 mg/kg (rat, oral) 4 mg/kg (sheep, oral) 15 mg/kg (mammal, oral) 8 mg/kg (rat, oral)[۳] |
||
| ترکیبات مرتبط | |||
| دیگر کاتیونها | پتاسیوم سیانید | ||
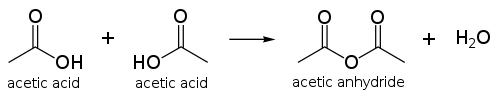
پرمنگنات پتاسیم
پتاسیم پرمنگنات ترکیبی معدنی است با فرمول شیمیایی KMnO۴. نمک آن از یونهای K+ و MnO۴- تشکیل شده است. سابقاً به آن پرمنگنات و پتاش هم میگفتند. پرمنگنات یک مادهٔ اکسندهٔ بسیار قوی است. در آب نیز محلول است و محلولی به رنگ ارغوانی تولید میکند که از تبخیر آن بلورهای منشوری و درخشان به رنگ ارغوانی بسیار تیره (مایل به سیاه) بر جای می ماند. در این ترکیب منگنز باعدد اکسایش ۷+ حضور دارد. توجه: این ماده با گلیسرین واکنش شدیدی میدهد،هیچگاه این دو ماده را کنار هم انبار نکرده و روی یک دیگر نریزید.

محلولی از پتاسیم پرمنگنات در آب درون بالن حجمی
محتویات
۱ساختار و تهیه
۲کاربردها
۲.۱صنایع سینمایی و تلویزیونی
۲.۲تصفیهٔ آب و ضدعفونی
۲.۳کاربردهای زیست پزشکی
۲.۴سنتزهای شیمی آلی
۲.۵تصفیه پسابهای صنعتی
۲.۶عیارسنجی در شیمی تجزیه
ساختار و تهیه[ویرایش]
از بلورهایی به شکل اورتورومبیک تشکیل شده که در آن a=910.۵pm و b=572.۰pm و c=742.۵pm است. (a و b و c به ترتیب طول، عرض و ارتفاع دستگاه بلوری اورتورومبیک است.)
همچنین طول پیوند Mn-O در این پیوند برابر ۱۶۲.۹pm است.
تهیهٔ صنعتی پتاسیم پرمنگنات از منگنز دی اکسید است، که خود از سنگ معدن پیرولوسیت به دست می آید. در این روش MnO۲ به دست آمده از پیرولوسیت با پتاسیم هیدروکسید مخلوط شده و در هوا یا در مجاورت پتاسیم نیترات (یک منبع اکسیژن) حرارت داده می شود. در این فرایند پتاسیم منگنات (K۲MnO۴) به دست می آید که در اکسایش الکترولیتی (الکترولیز) در محلول بازی به پتاسیم پر منگنات تبدیل می شود.
| 2 MnO2 + 4 KOH + O2 → 2 K2MnO4 + 2 H2O |
| 2 MnO42– + Cl2 → 2 MnO4– + 2 Cl– |
همچنین پرمنگنات را می توان از اثر دادن سرب دی اکسید (PbO۲) و یا سدیم بیسموتات (NaBiO۳) بر محلول +Mn۲ نیز به دست آورد. از رنگ بنفش روشن حاصل از این واکنش برای تست حضور یا عدم حضور منگنز نیز استفاده می شود.
| پتاسیم پرمنگنات | |
|---|---|
  |
|
| شناسنامه | |
| نام گذاری آیوپاک | پتاسیم منگنات (VII) |
| نامهای دیگر | پتاسیم پرمنگنات پرمنگنات پرمنگنات پتاسیم |
| فرمول شیمیایی | KMnO4 |
| خواص | |
| جرم مولی | 158.034 گرم بر مول |
| نما (ظاهر) | بلورهای سوزنی بنفش مایل به خاکستری |
| رنگ محلول | در محلول دارای رنگ شدید بنفش است که در غلظتهای چند ppm به رنگ ارغوانی در می آید |
| بو | بدون بو |
| چگالی | 2.703 گرم بر سانتیمتر مکعب |
| دمای ذوب | 240oC همراه با تجزیه شدن |
| حلالیت در آب | 6.38 گرم در 100mL آب (در دمای 20oC) 25 گرم در 100mL آب |
| حلالیت | در الکل و حلالهای آلی دیگر تجزیه می شود. |
| ساختار | |
| ساختار بلوری | دستگاه بلوری اورتورومبیک |
| ترموشیمی | |
| آنتالپی استاندارد تشکیل | 813.4- کیلوزول بر مول |
| آنتروپی استاندارد مولی | 171.7 ژول بر کلوین.مول |
| خطرات | |
| MSDS | External MSDS |
| طبقه بندی EU | اکسید کننده(در استفاده احتیاط کنید) مضر برای سلامتی خطرناک برای محیط زیست |
کربنات پتاسیم
| پتاسیم کربنات | |
|---|---|
 |
|
 |
|
 |
|
| شناساگرها | |
| شماره ثبت سیایاس | 584-08-7 |
| شمارهٔ آرتیئیسیاس | TS7750000 |
| خصوصیات | |
| فرمول مولکولی | K2CO3 |
| جرم مولی | 138.2055 g/mol |
| شکل ظاهری | جامد سفید نمگیر |
| چگالی | 2.29 g/cm3 solid |
| دمای ذوب | 891 °C |
| دمای جوش |
تجزیه میشود.
|
| انحلالپذیری در آب | 112 g/100 mL (20 °C) |
| خطرات | |
| لوزی آتش |
 0
2
0
|
| نقطه اشتعال | غیر مشتعل |
کلریدریک اسید مشخصات
هیدروکلریک اسید یک محلول شفاف، بیرنگ و بسیار تند بو از هیدروژن کلرید (HCl) در آب است. یک اسید معدنی بسیار خوردنده و یک اسید قوی با استفادههای صنعتی زیادی است. هیدروکلریک اسید به طور طبیعی در اسید معده یافت میشود. پیاچ (pH) این اسید بین ۰ تا ۲۲ میباشد.
هیدروکلریک اسید از قدیم به نامهای اسیدم سالیس، موریاتیک اسید و ارواح نمک معروف بوده و از ویتریول (سولفوریک اسید) و نمک طعام به دست آمد. هیدروکلریک اسید آزاد ابتدا در قرن شانزدهم توسط آندریاس لیباویوس رسماً معرفی شد. بعدتر، توسط شیمیدانهایی مثل ژوهان رودولف گلابر، جوزف پریستلی و همفری دیوی در تحقیقات علمی شان مورد استفاده قرار گرفت.
با آغاز تولید گسترده در انقلاب صنعتی، هیدروکلریک اسید در صنایع شیمیایی بعنوان یک واکنش گر ناب در تولید مقیاس بزرگ وینیل کلرید برای پلاستیک PVC، و MDI/TDI برای پلی یورتان مورد استفاده قرار گرفت. کاربریهای زیادتری هم در مقیاس کوچک دارد که شامل خانهداری، ساخت ژلاتین و دیگر افزودنیهای غذایی، رسوبزدایی و چرم سازی میباشد. حدود ۲۰ میلیون تن از هیدروکلریک اسید سالانه در جهان تولید میشود.
همچنین گفته میشود جابر بن حیان این اسید را کشف کرده است. ازاین اسید برای جرم گیری از سطوح مختلف استفاده میشود. هیدروکلریک اسید در معده نیزوجود دارد و به هضم غذا کمک میکند. تنفس بخارات هیدروکلریک اسید خطرناک است و به دستگاه تنفسی آسیب میرساند و اگر قطرهای از آن بر روی پوست بدن بچکد تولید تاول و حتی جراحات عمیق مینماید ودرچنین مواردی باید بلافاصله با محلول قلیایی رقیق مانند محلول سودا یا جوش شیرین اثر اسید را خنثی کرد.
محتویات
۱وجه تسمیه۲تاریخچه
۳خواص شیمیایی و واکنشها
۴خواص فیزیکی
۵تولید
۵.۱بازار صنعتی
۶کاربردها
۶.۱اسیدشویی فولاد
۶.۲تولید ترکیبات آلی
۶.۳تولید ترکیبات غیرآلی
۶.۴کنترل pH و خنثی سازی
۶.۵بازسازی مبدلهای یونی
۶.۶دیگر کاربرد های هیدروکلریک اسید
۷حضور در موجودات زنده
۸ایمنی
۹جستارهای وابسته
۱۰پیوند به بیرون
۱۱منابع
وجه تسمیه
هیدروکلریک اسید برای کیمیاگران اروپایی با عنوان ارواح نمک یا اسیدم سالیس (نمک اسید) شناخته شده بود. هر دو نام هنوز هم رایج هستند به خصوص در زبانهای غیر انگلیسی مثل زبان آلمانی: Salzsäure، زبان هلندی: Zoutzuur، زبان سامی شمالی: Saltsyra و زبان لهستانی: kwas solny. HCl گازی هوای اسید دریایی نامیده میشد. نام قدیمی (قبل از نام قاعده دار) موریاتیک اسید نیز ریشهٔ یکسانی دارد و بعضی اوقات به کار میرود (موریاتیک یعنی "مربوط به آب نمک یا نمک").[۱][۲]نام «هیدروکلریک اسید» توسط شیمیدان فرانسوی ژوزف لویی گیلوساک در ۱۸۱۴ ابداع شد.[۳]
تاریخچه
تیزاب سلطانی، مخلوطی از هیدروکلریک اسید و نیتریک اسید، که با حل شدن نشادر در نیتریک اسید تهیه میشود، توسط سئودو گبر (جابر بن حیان بدلی)، شیمیدان اروپایی قرن ۱۳ تشریح شد.[۴][۵][۶][۷][۸] دیگر مراجع اذعان دارند که اولین اشاره به تیزاب سلطانی در دست خطهای موجود امپراتوری روم شرقی با تاریخ اواخر قرن سیزدهم یافت شده است.[۹][۱۰][۱۱]
هیدروکلریک اسید آزاد اولین بار به صورت رسمی در قرن ۱۶ توسط آندریاس لیباویوس معرفی شده است که آن را با گرم کردن نمک در بوته چینی خاک رسی به دست آورد.[۱۲] دیگر نویسندگان ادعا میکنند که هیدروکلریک اسید خالص اولین بار توسط کاهن بندیکتی باسیل والنتین آلمانی در قرن ۱۵،[۱۳] با گرم کردن نمک طعام معمولی و آهن(II) سولفات کشف شده است.[۱۴] درحالیکه دیگران مدعی اند که هیچ مرجع قابل اعتمادی راجع به اینکه هیدروکلریک اسید خالص تا اواخر قرن شانزدهم به دست آمده باشد، وجود ندارد.[۱۵]
در قرن هفدهم، ژوهان رودولف گلابر از کارل اشتات آم ماین از نمک سدیم کلرید و سولفوریک اسید برای تهیهٔ سدیم سولفات در واکنش مانهایم استفاده کرد که گاز هیدروژن کلرید آزاد میکرد. جوزف پریستلی از لیدز انگلستان، هیدروژن کلرید خالص را در ۱۷۷۲ تهیه کرد،[۱۶] و در ۱۸۰۸ همفری دیوی از پزانس انگلستان، ثابت کرده بود که ترکیب شیمیایی شامل هیدروژن و کلر بوده است.[۱۷]
همزمان با انقلاب صنعتی در اروپا، تقاضا برای مواد قلیایی افزایش یافت. فرایند جدیدی توسط نیکولاس لبلانک (ایسودان، فرانسه) تولید ارزان قیمت و گستردهٔ سدیم کربنات (جوش شیرین) را ممکن کرد. در این فرایند لبلانک، نمک طعام با استفاده از سولفوریک اسید، سنگ آهک و زغال سنگ ضمن آزاد کردن هیدروژن کلرید به عنوان فرآوردهٔ جانبی، به جوش شیرین تبدیل میشود. تا زمان قانون قلیایی ۱۸۶۳ در برتانیا و قوانین مشابه در دیگر کشورها، HCll اضافی وارد هوا میشد. بعد از قانون گذاری، تولیدکنندگان جوش شیرین مجبور به انتقال گاز اتلافی به آب و جذب آن در آب شدند تا هیدروکلریک اسید در مقیاس صنعتی تولید کنند.[۱۸]
در قرن بیستم، فرایند لبلانک جای خود را به فرایند سولوای که فرآوردهٔ جانبی هیدروکلریک اسید تولید نمیکرد و موثرتر بود، داد. به خاطر آن که هیدروکلریک اسید همچنان بعنوان یک ماده شیمیایی مهم در کاربردهای متعدد شناخته میشد، میل تجاری روشهای تولید دیگری را نیز موجب شد که برخی همچنان به کار گرفته میشوند. بعد از سال ۲۰۰۰، هیدروکلریک اسید بیشتر با جذب هیدروژن کلرید اضافی از تولید ترکیبات آلی صنعتی تولید میگردد.[۱۸]
از ۱۹۸۸، هیدروکلریک اسید با عنوان پیشرو در جدول دوم پیمان نامه سازمان ملل علیه خرید و فروش غیرقانونی مواد مخدر و مواد روانگردان در سال ۱۹۸۸ به علت استفاده از آن در تولید و ساخت هروئین، کوکائین و مت آمفتامین ذکر شده است.[۱۹]
خواص شیمیایی و واکنشها
هیدروژن کلرید (HCl) اسید تک پروتونی است، به این معنی که میتواند فقط یک بار تفکیک شود (مثلا یونیزه) تا یک یون H+ (یک پروتون تنها) آزاد کند. در هیدروکلریک اسید آبی، H+ به یک مولکول آب میپیوندد تا یک یون هیدرونیوم، H3O+ تشکیل دهد:[۲۰][۲۱]
- HCl + H2O → H3O+ + Cl−
دیگر یون تشکیل شده Cl−، یون کلرید است؛ بنابراین هیدروکلریک اسید میتواند برای تهیه نمکهای کلرید، مثل سدیم کلرید به کار رود. هیدروکلریک اسید یک اسید قوی است چون در اصل به طور کامل در آب تفکیک میشود.
اسیدهای تک پروتون دار یک ثابت تفکیک اسیدی، Ka، دارد که نشانگر میزان تفکیک در آب است. برای یک اسید قوی مثل HCl، مقدار Ka بزرگ است. تلاشهای نظری برای اختصاص یک Ka به HCl انجام پذیرفتهاند.[۲۲] وقتی نمکهای کلرید مثل NaCl به HCl آبی اضافه میشوند، عملاً تأثیری بر pH ندارند، این یعنی که Cl− یک باز مزدوج بسیار ضعیف است و HCl کاملاً در محلول آبی تفکیک شده است. برای محلولهای متوسط تا قوی هیدروکلریک اسید، فرض اینکه مولاریتهی H+ (یک یکای غلظت) دقیقاً برابر با مولاریتهٔ HCl است، با توجه به چهار رقم معنی دار درست است.
از بین شش اسید معروف قوی از اسیدهای معدنی در شیمی، هیدروکلریک اسید، یک پروتون دارد و کمترین تمایل را به شرکت در یک واکنش اکسایش-کاهش دارد. برخلاف اسیدی بودن آن، یکی از کم خطرترین اسیدها برای استفاده است زیرا شامل یون کلرید واکنش ناپذیر و غیر سمی است. محلولهای نسبتاً قوی هیدروکلریک اسید ضمن نگهداری شان کاملاً پایدار هستند و غلظت آنها در زمان ثابت میماند. این ویژگیها به علاوهٔ این که به عنوان یک واکنشگر ناب خالص در دسترس است، هیدروکلریک را به یک واکنش گر اسیدی عالی مبدل میسازد.
هیدروکلریک اسید یک اسید مطلوب در تیتراسیون برای تعیین مقدار بازها است. تیترانتهای اسید قوی نتایج دقیق تری به خاطر نقطه پایانی متمایزشان میدهند. آزئوتروپ یا (محلول نقطه جوش ثابت) هیدروکلریک اسید (تقریبا ۲۰٫۲٪) را میتوان به عنواناستاندارد اولیه در تحلیلهای کمی به کار برد اگرچه، غلظت دقیق آن به فشار جوی که در آن تهیه شده است، بستگی دارد.[۲۳]
استفاده از هیدروکلریک اسید در شیمی تجزیه برای تهیه محلولها (ی "ساده") جهت تجزیه بسیار رایج است. هیدروکلریک اسید غلیظ گاز هیدروژن، کلریدهای فلز اکسید شده و فلزهای زیادی را در خود حل میکند و با ترکیبهای بازی مثل سدیم کربنات یامس (II) اکسید واکنش داده و کلریدهای حل شدهای را ترکیب میکند که قابل تحلیل هستند.
خواص فیزیکی
| غلظت | چگالی | غلظت مولار | پیاچ | گرانروی | ظرفیت گرمایی | فشار بخار | نقطه جوش | دمای ذوب | ||
|---|---|---|---|---|---|---|---|---|---|---|
| kg HCl/kg | kg HCl/m3 | Baumé | kg/L | mol/dm3 | mPa•s | kJ/(kg•K) | kPa | °C | °C | |
| ۱۰٪ | ۱۰۴٫۸۰ | ۶٫۶ | ۱٫۰۴۸ | ۲٫۸۷ | −۰٫۵ | ۱٫۱۶ | ۳٫۴۷ | ۱٫۹۵ | ۱۰۳ | −۱۸ |
| ۲۰٪ | ۲۱۹٫۶۰ | ۱۳ | ۱٫۰۹۸ | ۶٫۰۲ | −۰٫۸ | ۱٫۳۷ | ۲٫۹۹ | ۱٫۴۰ | ۱۰۸ | −۵۹ |
| ۳۰٪ | ۳۴۴٫۷۰ | ۱۹ | ۱٫۱۴۹ | ۹٫۴۵ | −۱٫۰ | ۱٫۷۰ | ۲٫۶۰ | ۲٫۱۳ | ۹۰ | −۵۲ |
| ۳۲٪ | ۳۷۰٫۸۸ | ۲۰ | ۱٫۱۵۹ | ۱۰٫۱۷ | −۱٫۰ | ۱٫۸۰ | ۲٫۵۵ | ۳٫۷۳ | ۸۴ | −۴۳ |
| ۳۴٪ | ۳۹۷٫۴۶ | ۲۱ | ۱٫۱۶۹ | ۱۰٫۹۰ | −۱٫۰ | ۱٫۹۰ | ۲٫۵۰ | ۷٫۲۴ | ۷۱ | −۳۶ |
| ۳۶٪ | ۴۲۴٫۴۴ | ۲۲ | ۱٫۱۷۹ | ۱۱٫۶۴ | −۱٫۱ | ۱٫۹۹ | ۲٫۴۶ | ۱۴٫۵ | ۶۱ | −۳۰ |
| ۳۸٪ | ۴۵۱٫۸۲ | ۲۳ | ۱٫۱۸۹ | ۱۲٫۳۹ | −۱٫۱ | ۲٫۱۰ | ۲٫۴۳ | ۲۸٫۳ | ۴۸ | −۲۶ |
| دما و فشار مرجع برای جدول فوق ۲۰˚C و ۱ اتمسفر (101.325 kPa) است. مقادیر فشار بخار از جداول بینالمللی بحرانی اخذ شدهاند و همان فشار بخار کل محلول هستند. | ||||||||||

خواص فیزیکی هیدروکلریک اسید، مثل نقطه جوش و دمای ذوب، چگالی و pH بستگی به غلظت یا مولاریته HCl در محلول آبی دارند که از خواص آب در غلظتهای نزدیک به ۰٪ اسید تا مقادیر بخاری هیدروکلریک اسید در بیش از 40% HCl متغیر هستند.[۲۶]
هیدروکلریک اسید به عنوان مخلوط دوتایی (دو جزئی) از HCl و H2O آزئوتروپ نقطه جوش ثابتی در 20.2% HCl و ۱۰۸٫۶ ˚F (227 ˚F) دارد. چهار نقطه اوتکتیک ثابت بلوری شدن برای هیدروکلریک اسید، بین شکلهای بلور HCl•H2O (68% HCl)، HCl•2H2O (51% HCl)، HCl•3H2O (۴۱٪)، HCl•6H2O (25% HCl) و یخ (0% HCl) وجود دارد. هم چنین نقطه ثابت اوتکتیک در ۲۴٫۸٪ بین یخ و بلور HCl•3H2O موجود است.
تولید
هیدروکلریک اسید با حل شدن هیدروژن کلرید در آب تهیه میشود. هیدروژن کلرید را میتوان با روشهای گوناگونی تولید کرد و این یعنی راههای زیادی برای ساخت هیدروکلریک اسید موجودند. تولید مقیاس بزرگ هیدروکلریک تقریباً همیشه با تولید در مقیاس صنعتی دیگر مواد شیمیایی انجام میپذیرد.
بازار صنعتی
هیدروکلریک اسید در محلولهای تا ۳۸٪ از HCl (مقدار غلیظ) تهیه میشود. غلظتهای بیشتر فقط تا ۴۰٪ از نظر شیمیایی قابل تولید هستند، اما نرخ تبخیر از آن به بعد به قدری بالا است که نگهداری و استفاده از آن نیازمند ملاحظات اضافی تری است مثل دما و فشار پایین. پس میزان عمدهٔ صنعتی آن ۳۰٪ تا ۳۴٪ است که با توجه به حمل و نقل مناسب و اتلاف مادهٔ محدود به علت بخارهای HCl بهینه شده است. غلظتهای بیشتر را به جهت کنترل اتلاف از طریق تبخیر باید فشرده و سرد نمود. در ایالات متحده، محلولهای بین ۲۰٪ تا ۳۲۲٪ با نام اسید موریاتیک فروخته میشوند. محلولهای مورد استفاده اغلب برای نظافت خانهها در ایالات متحده، معمولاً ۱۰٪ تا ۱۲۲٪ هستند که هشدارهای جدی برای رقیقتر کردن شان قبل از استفاده دارند. در بریتانیا، که با نام «ارواح نمک» برای نظافت خانگی فروخته میشود، قدرت اسید برابر همان مقدار در ایالات متحده است.
تولید کنندگان بزرگ جهانی شامل شرکت داو کمیکال ۲ میلیون تن در سال از HCl گازی، شرکت جرجیا گالف، شرکت توسوه، آکزونوبل و تساندرلو بین ۰٫۵ تا ۱٫۵ میلیون تن در سال تولید دارند. تولید کل جهان، که برای استفادههای آماری بر اساس میزان HCl توصیف شده است، حدود ۲۰ میلیون تن در سال تخمین زده میشود که ۳ میلیون تن از طریق تولید مستقیم و مابقی از طریق استفاده از ترکیبهای آلی و مشابه و تولید فرآوردهٔ ثانوی تأمین میگردند. تا کنون، غالب هیدروکلریک اسید منحصراً توسط تولید کننده مصرف میشود. میزان آن در بازار آزاد جهانی ۵۵ میلیون تن در سال تخمین زده میشود.
کاربردها
هیدروکلریک اسید یک اسید قوی غیر آلی است که در اکثر فرآیندها مثل پالایش فلزات به کار میرود. استفادهٔ مورد نظر معمولاً کیفیت محصول مورد نیاز را نشان میدهد.
اسیدشویی فولاد
یکی از مهمترین استفادههای هیدروکلریک اسید در اسیدشویی فولاد است تا زنگ یا اکسید آهن را از روی آهن یا فولاد قبل از ورود آنها به واکنشهای بعدی مثل اکستروژن، نورد، "گالوانی کردن و دیگر تکنیکها، بزداید. HCl در کیفیت فنی با غلظت معمولاً ۱۸٪ رایجترین عامل اسیدشویی برای اسیدشویی فولادهای کربنی است.
- Fe2O3 + Fe + 6 HCl → 3 FeCl2 + 3 H2O
اسید مصرف شده استفادهٔ بسیاری در محلولهای کلرید آهن (II) (هم چنین معروف به فررو کلرید) دارد اما مقادیر بالای فلزات سنگین در مایع اسیدشویی این عملیات را با مشکل مواجه کرده است.
صنعت اسیدشویی فولاد فرآیندهای بازسازی هیدروکلریک اسید را بهبود بخشیده است، مثل فرایند بازسازی HCl سرخ کنندهٔ اسپری یا بستر سیال که بازیافت HCl را از مایع اسیدشویی مصرف شده ممکن میسازد. رایجترین فرایند بازسازی فرایند پیروهیدرولیز طی واکنش زیر است:
- 4 FeCl2 + 4 H2O + O2 → 8 HCl+ 2 Fe2O3
با بهبودی اسید مصرف شده یک حلقه اسیدی بسته ساخته میشود. فرآوردهٔ جانبی اکسید آهن (II) از واکنش بازسازی باارزش است چون در بسیاری از صنایع ثانوی به کار میرود.
تولید ترکیبات آلی
دیگر استفاده مهم هیدروکلریک اسید در تولید ترکیبات آلی، مثل وینیل کلرید و دی کلرواتان برای پلی وینیل کلراید (PVC) است. معمول این کار یک استفادهٔ غیرآزاد است زیرا مصرف محلی هیدروکلریک اسید تولید شده در واقع به بازار آزاد نمیرسد. دیگر ترکیبات آلی تولید شونده توسط هیدروکلریک اسید عبارتند از بیسفنول ای برای پلی کربنات، کربن فعال و اسید اسکوربیک مثل تولیدات متعدد داروهای شیمیایی.
- 2 CH2=CH2 + 4 HCl + O2 → 2 ClCH2CH2Cl + 2 H2O (دی کلرواتان توسط اکسی کلری شدن)
چوب + HCl + حرارت ← کربن فعال (فعال سازی شیمیایی)
تولید ترکیبات غیرآلی
محصولات زیادی توسط هیدروکلریک اسید طی یک واکنش اسید و باز طبیعی منجر به ترکیبات معدنی (غیرآلی) تولید میشوند و هم چنین مواد شیمیایی درگیر با آب مثل کلرید آهن (III) و پلی آلومینیوم کلراید (PAC).
- Fe2O3 + 6 HCl → 2 FeCl3 + 3 H2O (کلرید آهن (III) از مگنتیت)
کلرید آهن (III) و PAC هر دو بعنوان عوامل لخته سازی و انعقاد در تصفیه آب و فاضلاب، تولید آب آشامیدنی و تولید کاغذ به کار میروند. دیگر ترکیبات معدنی تولید شونده با هیدروکلریک اسید شامل کلرید کلسیم، نمک پخش در جاده، کلرید نیکل (II) برای آبکاری الکتریکی و کلرید روی برای صنعتگالوانی کردن و تولید باتری هستند.
- CaCO3 + 2 HCl → CaCl2 + CO2 + H2O (کلرید کلسیم از سنگ آهک)
کنترل pH و خنثی سازی
هیدروکلریک اسید هم چنین برای تنظیم اسیدی بودن (pH) محلولها به کار میرود.
- OH− + HCl → H2O + Cl−
در خلوص مورد نیاز صنایع (غذایی، دارویی، آب آشامیدنی)، هیدروکلریک اسید با کیفیت برای تنظیم pH فرایند جریانهای آبی مورد استفاده قرار میگیرد. در صنایع کم تقاضا، هیدروکلریک اسید با کیفیت فنی برای خنثی سازی جریانهای اتلافی و مراقبت از استخر شنا به کار گرفته میشود.
بازسازی مبدلهای یونی
هیدروکلریک اسید پر کیفیت در بازسازی یک رزین مبدل یون به کار گرفته میشود. تبادل کاتیون به طور گسترده برای حذف یونهایی مثل Na+ و Ca2+ از محلولهای آبی در تولید آب معدنی شده مورد استفاده قرار میگیرد. اسید برای شستن کاتیونها از رزینها به کار میرود. Na+ با H و Ca2+ با 2HHجایگزین میشود.
مبادله میشوند. مبدلهای یونی و آب معدنی در تمام صنایع شیمیایی، تولید آب آشامیدنی و اکثر صنایع غذایی مورد استفاده قرار میگیرند.
دیگر کاربرد های هیدروکلریک اسید
هیدروکلریک اسید در تعداد زیادی از کاربریهای مقیاس کوچک مثل فرایند چرم سازی، خالص سازی نمک طعام، نظافت و خانهداری،[۲۷] و بنای ساختمانها به کار میرود. تولید نفت را میتوان با تزریق هیدروکلریک اسید در بستر صخرهای یک چاه نفت، حل کردن یک بخش از صخره و ساختن یک منفذ بزرگ تحریک کرد. اسیدزنی چاه نفت یک فرایند معمول در صنعت تولید نفت دریای شمال است.
هیدروکلریک اسید برای حل کردن کلسیم کربنات نیز به کار میرود به عنوان مثال برای پوسته پوسته کردن کتریها و برای پاک کردن ملات از آجرکاریها. البته یک مایع خطرناک است که باید با دقت کافی از آن استفاده کرد. ضمن استفاده روی یک آجرکاری، واکنش آن با ملات تا جایی که کل اسید تبدیل شود ادامه مییابد و کلسیم کربنات، کربن دی اکسید و آب را به همراه دارد:
2HCl + CaCO3 → CaCl2 + CO2 + H2O
اکثر واکنشهای شیمیایی هیدورکلریک اسید در تولید غذا، مواد تشکیل دهنده غذا و افزودنیهای غذایی به کار گرفته میشوند. محصولات رایج عبارتند از آسپارتام، فروکتوز، سیتریک اسید، لیزین، پروتئین گیاهی هیدرولیز شده با اسید به عنوان مقوی غذایی، و در تولید ژلاتین. هیدروکلریک اسید مورد استفاده در صنایع غذایی (خیلی خالص) را میتوان موقع نیاز برای محصول نهایی به کار برد.
در سیاره زهره ابرهایی از هیدروکلریک اسید با غلظت کم وجود دارد.
حضور در موجودات زنده

اسید معده یکی از ترشحات اصلی معده است و به طور عمده شامل هیدروکلریک اسید بوده و محتوای معده را طوری اسیدی میکند که پی اچ بین ۱ و ۲ داشته باشد.[۲۸][۲۹]
یونهای کلرید (Cl−) و هیدروژن (H+) در ناحیهٔ بالایی معده توسط یاخته جداری از مخاط اسید معده ترشح میشوند و به سمت یک شبکهٔ ترشحی به نام کانالیکولی قبل از اینکه وارد حفره پایینی معده شوند، هدایت میشوند.[۳۰]
اسید معده مانند یک سد مقابل ریزاندامهها برای جلوگیری از عفونتها ظاهر میشود و برای هضم غذا اهمیت زیادی دارد. پی اچ پایین آن پروتئینها را دناتوره میکند و در نتیجه آنها را برای تخریب توسط آنزیمهای گوارشی مثل پپسین حساس میکند. پی اچ پایین هم چنین آنزیم پیشروی پپسینوژن را فعال و تبدیل به آنزیم فعال پپسین (با خودشکافی) میکند. بعد از ترک معده، هیدروکلریک اسید کیموس توسط سدیم بی کربنات در دوازدهه خنثی میشود.
خود معده با ترشح لایهٔ ضخیم مخاط، و با سکرتین ناشی از محلول بافر سدیم بی کربنات در مقابل این اسید قوی از خود محافظت میکند. سوزش یر دل یا زخم معده وقتی این مکانیزمها دچار مشکل شوند، رخ میدهند. داروهای آنتی هیستامین و دستههای مهارکنندههای پروتون پمپ میتوانند تولید اسید در معده را مهار کنند، و آنتاسیدها نیز برای خنثی تر کردن اسید موجود مورد استفاده قرار میگیرند.[۳۱]
ایمنی
| غلظت بر حسب وزن | طبقهبندی[۳۲] | کد ایمنی |
|---|---|---|
| ۱۰–۲۵٪ | محرک (Xi) | R36/37/38 |
| > ۲۵٪ | خورنده (C) | R۳۴ R۳۷ |
هیدروکلریک اسید غلیظ (هیدروکلریک اسید بخار) مههای اسیدی تشکیل میدهد. مه و محلول هر دو تأثیر خورنده بازگشت ناپذیری بر بافت انسان با قابلیت تخریب اندامهای تنفسی، چشمها، پوست و رودهها دارند. پس از اختلاط هیدروکلریک اسید بامواد شیمیایی اکسید کنندهٔ معمول مثل سدیم هیپوکلریت (سفیدکننده، NaClO) یا پتاسیم پرمنگنات (KMnO4)، گاز سمی کلر تولید میشود.
- NaClO + 2 HCl → H2O + NaCl + Cl2
- 2 KMnO4 + 16 HCl → 2 MnCl2 + 8 H2O + 2 KCl + 5 Cl2
تجهیزات ایمنی مثل دستکشهای لاستیکی یا PVC، عینکهای ایمنی محافظ چشم و کفشها و لباسهای مقاوم در برابر مواد شیمیایی برای به حداقل رساندن خطرات استفاده از هیدروکلریک اسید به کار میروند. آژانس حفاظت محیط زیست ایالات متحده آمریکا هیدروکلریک اسید را یک مادهٔ سمی معرفی کرده و مقررات آن را تنظیم مینماید.[۳۳]
شماره بینالمللی کالاهای خطرناک یا شمارهٔ وزارت ترابری آمریکا (DOT) آن ۱۷۸۹ است. این شماره روی یک پلاکارد بر روی محفظه نمایش داده میشود.
| شناساگرها | |
|---|---|
| شماره ثبت سیایاس | ۷۶۴۷–۰۱-۰ |
| شمارهٔ آرتیئیسیاس | MW4025000 |
| خصوصیات | |
| فرمول مولکولی | HCl in آب (H2O) |
| جرم مولی | 36.46 g/mol (HCl) |
| شکل ظاهری | Clear colorless to light-yellow liquid |
| چگالی | 1.18g/cm3 |
| دمای ذوب | −27.32 °C (247 K) 38% solution. |
| دمای جوش |
110 °C (383 K)
20.2% solution; 48 °C (321 K) 38% solution. |
| انحلالپذیری در آب | Miscible. |
| اسیدی (pKa) | −8.0 |
| گرانروی | 1.9 mPa·s at 25 °C 31.5% solution |
| خطرات | |
| MSDS | External MSDS |
| طبقهبندی ئییو | |
| کدهای ایمنی | R۳۵, R۳۷ |
| شمارههای نگهداری | S26, S۳۶, S45 |
| خطرات اصلی | Corrosive |
| لوزی آتش |
 0
3
1
COR
|
| نقطه اشتعال | Non-flammable. |
| ترکیبات مرتبط | |
| دیگر آنیونها | F- Br- I- |
| مرتبط با acids | هیدروبرومیک اسید هیدروفلوئوریک اسید هیدروژن یدید سولفوریک اسید |
اسید کرومیک مشخصات
اسید کرومیک (به انگلیسی: Chromic acid) یک ترکیب شیمیایی با شناسه پابکم ۲۴۴۲۵ است. شکل ظاهری این ترکیب، بلورهای قرمز است.
| شناساگرها | |
|---|---|
| شماره ثبت سیایاس | 7738-94-5 |
| پابکم | 24425 |
| کماسپایدر | 22834 |
| شمارهٔ ئیسی | 231-801-5 |
| ChEBI | CHEBI:33143 |
|
مرجع جیملین
|
25982 |
| جیمول-تصاویر سه بعدی | Image 1 Image 2 |
| خصوصیات | |
| فرمول مولکولی | H2CrO4 |
| جرم مولی | ۱۱۸٫۰۱ g mol−1 |
| شکل ظاهری | Red crystals |
| چگالی | 1.201 g cm-3 |
| دمای ذوب | ۱۹۷ درجه سلسیوس (۳۸۷ درجه فارنهایت; ۴۷۰ کلوین) |
| دمای جوش |
250 °C, 523 K, 482 °F decomposes
|
| انحلالپذیری درآب | 1666.6 g dm-3 |
استیک اسید مشخصات
اسید استیک یا نام آیوپاک آن اتانوئیک اسید، جوهر انگور یا جوهر سرکه جز اسیدهای آلی (از گروه کربوکسیلیک اسیدها) است. فرمول آن CH3COOH است.
محتویات
۱نگاه کلی
۲نامگذاری
۳تاریخچه
۴خواص شیمیایی
۵حلال
۶واکنشهای شیمیایی
۷شناسایی
۸بیوشیمی
۹تولید
۹.۱روشهای تولید صنعتی اسید اسیتیک
۱۰کربندارکردن متانول
۱۱اکسایش استالدئید
۱۲اکسایش اتیلن
۱۳تخمیر
۱۴کاربردها
۱۵استات وینیل تکپاره
۱۶تولید استر
۱۷آنیدرید استیک
۱۸سرکه
۱۹کاربرد به عنوان حلال
۲۰سایر کاربردها
۲۱ایمنی
۲۲جستارهای وابسته
۲۳منابع
۲۴پیوند به بیرون
۲۵پانویس
نگاه کلی
اسید استیک جز اسیدهای کربوکسیلیک میباشد و در نامگذاری آیوپاک به اسید اتانوئیک معروف است. این اسید دارای فرمول شیمیایی میباشد و در قسمت چشایی طعم ترشی، شبیه طعم سرکه میدهد.
این اسید یک اسید ضعیف بوده زیرا تنها مقداری اسید جدا شده در محلول آبی می باشد. استیک اسید بدون آب و خالص (استیک اسید یخی) یک مایع بدون رنگ بوده که آب را از محیط اطرافش جذب میکند(هیگروسکوپی) و در دمای 16.5 C(62 F) به شکل یک جامد کریستالی بی رنگ منجمد می شود. اسید خالص و محلول های غلیظ آن بسیار خورنده هستند.
استیک اسید یکی از ساده ترین کربکسیلیک اسید ها است. این اسید یک معرف شیمیایی مهم بوده و یک ماده شیمیایی صنعتی مورد استفاده در تولید مواد زیر است: پلی اتیلن ترفتالات که به صورت عمده در بطری های نوشابه استفاده می شود؛ سلولوز استات که به طور عمده در فیلم عکاسی استفاده می شود؛ پلی وینیل استات برای چسب چوب به علاوه فایبر ها و فابریک های مصنوعی. در خانه، استیک اسید رقیق برای بازکردن لوله ها استفاده می شود. در صنعت غذا، استیک اسید تحت کد افزودنی E2600 به عنوان تنظیم اسیدی و به عنوان چاشنی استفاده می شود.
تقاضای جهانی استیک اسید در حدود 6.5 میلیون تون در سال (Mt/a) که حدود 1.5 Mt/a از طریق بازیافت برآورده می شود. باقی آن توسط بازار خوراک پتروشیمیایی یا منابع بیولوژیکی تولید می شود. استیک اسید رقیق تولید شده توسط تخمیر طبیعی، سرکه نامیده می شود.
باکتریهای مخمر سرکه به دلیل تمایل به تولید اسید استیک به این نام معروف شدهاند. این باکتریها در مواد غذایی، آب و خاک یافت میشوند. اسید استیک بطور طبیعی از میوهها و برخی مواد غذایی فاسد شده از فرایند تخمیر تولید میشوند و از قدیمیترین ترکیبات شیمیایی شناخته شده توسط انسان میباشد.
نامگذاری
نام «اسید استیک» رایجترین و رسمیترین نامی است که توسط IUPAC برای این ماده بکار میرود. این نام از کلمه لاتین acetum، به معنی سرکه، گرفته شدهاست. «اسید اتانوئیک» که به عنوان مترادف آن بکار میرود، یک نام سازمانیافتهاست که گاهی در معرفی نامگذاری مواد شیمیایی عنوان میشود.
«اسید استیک منجمد» یک نام سطحی برای اسید استیک بدون آب است. مثل نام آلمانی Eisessig(که به صورت تحتاللفظی به معنای سرکه یخی است)، این نام، از نام کریستالهایی برگرفته شده که در دمای اندکی زیر ۷/۱۶ درجه سانتیگراد(حدود ۶۲۲ درجه فارنهایت) شکل میگیرند.
رایجترین و رسمیترین نام اختصاری برای اسید استیک AcOH یا HOAc است که در آن Ac مخفف گروه عاملی|گروه استیل است CH۳−C(=O)−؛ در واکنشهای اسیدی، علامت اختصاری HAc بکار میرود که در آن Ac مخفف استات آنیون (CH۳COO−) میباشد، هر چند که بسیاری این نامگذاری را گمراه کننده میدانند. باید توجه داشت که در حالتی دیگر نباید Ac را با مخفف عنصر شیمیایی اکتینیم اشتباه گرفت.
فرمول ساده اسید استیک CH۲O و فرمولی مولکولی آن C۲H۴O۲ است. حالت آخر با هدف نشان دادن بهتر ساختار، بصورت CH۳-COOH, CH۳COOH، یا CH۳CO۲H نوشته میشود. یونی که در نتیجه حذف پروتون (H+) از اسید استیک به جا میماند «استات» آنیون نام دارد. همچنین نام «استات» به نمکی که حاوی این آنیون یا یک استر اسید استیک باشد اطلاق میگردد.
تاریخچه

اسید استیک منجمد
قدمت سرکه به اندازه عمر تمدن و حتی بیشتر است. اسید استیکهای باکتریزا در همه جای جهان وجود دارند و هر فرهنگی که در آن عملآوری خمر همچون آبجو یا شراب وجود داشته، به ناچار سرکه را نیز که نتیجه طبیعی تماس ایننوشیدنیهای الکلی با هوا بوده کشف کردهاند.
استفاده از اسید استیک در شیمی، به عهد باستان برمیگردد. در قرن سوم پیش از میلاد، تئوفراستوس فیلسوف یونانی|یونان تشریح کرد که سرکه چگونه بر روی فلزات اثر میکند تا از واکنش آنها رنگدانههای مورد استفاده در کارهای هنری تولید شوند که از آن جمله میتوان به «سرب سفید» (کربنات سرب) و «زنگار مس» اشاره کرد که ترکیبی سبز رنگ از نمکهای مس از جمله استات مس ۲ میباشد. رومیان باستان، شراب ترشیده را در ظرفهای سربی میجوشاندند تا از آن یک شربت بسیار شیرین با نام «ساپا» تهیه کنند. ساپا سرشار از استات سرب بود که به آن «شکر سرب» یا «شکر (افسانه)زحل میگفتند و اشراف روم آنرا در مسمومسازی با سرب بکار میگرفتند. در قرن هشتم، جابر بن حیان کیمیاگر ایرانی از طریق تقطیر اسید استیک را از سرکه جدا کرد.
در دوران رنسانس، اسید استیک منجمد از طریق تقطیر خشک استاتهای فلزی تهیه میشد. در قرن شانزدهم، آندریاس لیباویوس کیمیاگر آلمانی چنین رویهای را تشریح کرد و اسید استیک منجمد حاصل از این روش را با سرکه مقایسه کرد. وجود آب در سرکه بر ویژگیهای اسید استیک چنان تاثیر عمیقی داشت که شیمیدانها تا قرنها معتقد بودند که اسید استیک منجمد و اسیدی که در سرکه یافت میشود دو ماده مختلف هستند. پیر آدت شیمیدان فرانسوی ثابت کرد که این دو در حقیقت یکی هستند.
در سال ۱۸۴۷، هرمان کولب شیمیدان آلمانی برای اولین بار از طریق مواد معدنی موفق به ساخت اسید استیک شد. ترتیب این واکنش عبارت بود از کلردار کردن دی سولفید کربن و تبدیل آن به تترا کلراید کربن، سپس از طریق تفکافت به تتراکلورو اتیلن و از طریق کلردار کردن آبی به اسید تری کلرواستیک و در نهایت کاهش آن از طریق برقکافت به اسید استیک.
.[۲]

اسید استیک
تا سال ۱۹۱۰، اسید استیک منجمد اغلب از «تقطیر مشروبات الکلی» یا تقطیر چوب بدست میآمد. با استفاده از هیدروکسید کلسیم را جدا میکردند؛ سپس استات کلسیم به جا مانده را با استفاده از اسید سولفوریک اسیدی میکردند تا از آن اسید استیک بدست آید. در همین زمان، آلمان ۱۰٫۰۰۰ تن اسید استیک منجمد تولید میکرد که ۳۰درصد از آن برای تولید رنگ نیل استفاده میشد.[۳][۴]
خواص شیمیایی
؛ قدرت اسیدی اتم هیدروژن (H) در گروه کربوکسیل (−COOH) در اسیدهای کربوکسیلیک همچون اسید استیک، میتواند به عنوان یک یون (پروتون) H+ آزاد شود و به آنها خاصیت اسیدی دهد. اسید استیک در محلولهای آبی یک اسید تکپروتونی مؤثر است با ارزش ثابت تفکیک اسیدی(pKa) آن   ۰/ ۱ A ۸/۴; pH مولاریته محلول آن (در حدود انسجام سرکه خانگی) ۴/۲ است که نشان میدهد ۴/۰ درصد از مولکولهای اسید استیک تفکیک یافتهاند.

دی مر چرخهای اسید استیک؛ خطوط تیره نشاندهنده پیوندهای هیدروژنی هستند
ساختار کریستالی اسید استیک [۵] نشان میدهد که مولکولها به صورت دی مر جفت میشوند که پیوندهای هیدروژنی آنها را به هم متصل کردهاست. دی مرها را میتوان در بخار ۱۲۰درجه سانتی گراد شناسایی کرد. این حالت ممکن است در فاز مایع اسید استیک خالص نیز رخ دهد اما در صورت وجود آب، به سرعت به هم میریزد. سایر اسیدهای کربوکسیلیک پایینتر نیز این رفتار دیمرسازی را دارند.
حلال
اسید استیک مایع، مانند آب و اتانول یک حلال پروتوندار آبدوست (مولکول قطبی|قطبی) است. این ماده با ثابت دی الکتریک ۲/۶، میتواند علاوه بر حل کردن ترکیبات قطبی همچون نمکهای معدنی و شکرها، ترکیبات غیر قطبی همچون روغنها وعناصر شیمیایی مثل سولفور و آیودین را در خود حل کند. این ماده با بسیاری از حلالهای قطبی و غیر قطبی همچون آب، کلروفورم و هگزان مخلوط میشود. این خاصیت انحلال و امتزاجپذیری اسید استیک آنرا به یک ماده شیمیایی پرکاربرد صنعتی تبدیل کردهاست.
واکنشهای شیمیایی
اسید استیک برای بسیاری از فلزات از جمله آهن، منیزیم و روی خاصیت خورندگی دارد و در واکنش با آنها، گاز هیدروژن و نمکهای فلزی به نام استاتها تولید میکند. با قرار گرفتن آلومینیوم در معرض اکسیژن، یک لایه نازک از اکسید آلومینیوم بر روی سطح آن ایجاد میشود که نسبتاً مقاوم است. در نتیجه تانکرهای آلومینیومی در حملونقل اسید استیک مورد استفاده قرار میگیرند. استاتهای فلزی را میتوان از واکنش اسید استیک با یک باز نیز بدست آورد؛ که نمونه مشهور آن واکنش « جوش شیرین = سرکه» میباشد. به جز استات کرومیم ۲۲، تقریباً کلیه استاتها در آب قابل حل هستند.

واکنشهای شیمیایی عادی یک اسد کربوکسیلیک در مورد اسید استیک اتفاق میافتد که تشکیل اتانول از طریق کاهش و تشکیل مشتقاتی همچون کلرید استیل از طریق استخلاف هستهدوست اسیل، از موارد قابل توجه آن هستند. دیگر مشتقات استخلافی عبارتند از آنیدریدهای استیک؛ این آنیدرید از طریق از دست دادن آب در دو مولکول اسید استیک رخ میدهد. به همین ترتیب، استرهای اسید استیک میتوانند از طریق استری کردن فیشری تشکیل شوند و آمیدها نیز به همین ترتیب بوجود آیند. در صورتیکه اسید استیک در معرض حرارت بالای ۴۴۰ درجه سانتیگراد قرار گیرد، تجزیه شده و از آن دی اکسید کربن و متان یا کتن و آب تولید میشود.
شناسایی
اسید استیک را میتوان از طریق بوی خاص آن شناخت. یک واکنش رنگی برای نمکهای اسید استیک محلول کلرید آهن ۳ است که رنگ قرمز سیر ایجاد میکند که پس از اسیدیسازی ناپدید میشود استاتها وقتی با تری اکسید آرسنیک از اکسید کاکودیل حرارت داده میشوند، از طریق بوی بدی که تولید میکنند قابل شناسایی هستند.
بیوشیمی
گروه عامل|گروه استیل، که از اسید استیک مشتق شدهاند تقریباً در بیوشیمی کلیه گونههای حیات نقشی بنیادین دارند. آنها در مجاورت با کوآنزیم A به مهمترین قسمت متابولیسم کربوهیدراتها و چربیها تبدیل میشوند. در عین حال، به خاطر جلوگیری از برهم خوردن کنترل pH محتویات سلولی، تجمع اسید استیکهای آزاد در سلولها در سطوح پایین حفظ میشود. برخلاف اسیدهای کربوکسیلیک با زنجیره بلندتر(اسیدهای چرب)، اسید استیک در تری گلیسریدهای طبیعی بوجود نمیآید. در عین حال، تری گلیسیرید مصنوعی تری استین (گلیسیرین تری استات) یک افزودنی غذایی متداول است و در مواد آرایشی و داروهای موضعی بکار گرفته میشوند.
اسید استیک توسط برخی میکروبهای گیاهی تولید و دفع|مدفوع میشوند که از مهمترین آنها میتوان به دسته «بچه سرکه» و کلوستریدیم استو بیتی لیکیوم اشاره کرد. این باکتریها در همه جا در مواد غذایی، آب و خاک یافت میشوند و با گندیدن میوهها و سایر غذاها، اسید استیک بطور طبیعی تولید میشود. اسید استیک همچنین یکی از ترکیبات لیزکننده مهبلی آدمیزاد و سایر پستانداران نخستی است و در آنجا به عنوان یک عامل ضد باکتری ملایم عمل میکند.[۶]
تولید
کارخانه تصفیه و تغلیظ اسید استیک در سال 1884
اسید استیک، هم بطور مصنوعی و هم از طریق تخمیر باکتریایی، تولید میشود. امروزه روش باکتریایی تنها ۱۰ درصد از تولید را به خود اختصاص دادهاست اما به دلیل اینکه قوانین جهانی مربوط به سلامت غذا بر تهیه سرکه خوراکی از مواد بیولوژیکی تاکید میکند، این روش همچنان برای تولید سرکه استفاده میشود. تقریباً حدود ۷۵ درصد از اسید استیک تولید شده برای استفادههای صنعتی، از کربندار کردن متانول و به روشی که در زیر میآید تولید میشود. برای بقیه مصارف، از روشهای دیگر استفاده میشود.[۷]
کل تولید جهانی اسید استیک   ۵ میلیون تن در سال برآورد میشود که نیمی از آن در ایالات متحده تولید میشود. تولید این ماده در اروپا ۱ میلیون تن در سال است که میزان آن رو به کاهش نهاده؛ در ژاپن نیز تولید این ماده ۷/۰ میلیون تن در سال است. از سوی دیگر هرسالانه ۵/۱ میلیون تن اسید استیک بازیافت میشود که تولید جهانی را به ۵/۶ میلیون تن در سال میرساند.[۸][۹]
بزرگترین تولیدکنندگان اسید استیک دست نخورده، سلانس و بیپی|صنایع شیمیایی بی پی هستند. از دیگر تولیدکنندگان عمده این ماده میتوان به ملنیوم کمیکالز، استرلینگ کمیکالز، سام سونگ، ایستمن و سوونسک اتانول کمی اشاره کرد.
روشهای تولید صنعتی اسید اسیتیک
کربونیلاسیون متانول : در این روش متانول با مونوکسید کربن در فشارهای بالا (۲۰۰atm) واکنش داده و اسید استیک تولید میکند. این روش از سال ۱۹۲۰ ابداع شدهاست و به دلیل ارزان بودن متانول و از لحاظ اقتصادی مقرون به صرفهاست.
اکسیداسیون بوتان : از حرارت دادن بوتان با اکسیژن هوا در حضور یونهای فلزی منگنز، کبالت و کروم، پروکسید تولید میشود. پروکسید در اثر تجزیه اسید استیک ایجاد میکند.
{۲C_۴HiO + CO_۲ → ۴CH_۳COOH + ۲H_۲O}
اکسیداسیون استالدئید : استالدئید در شرایط ملایم و در حضور کاتالیزورهای ساده فلزی مثل منگنز و کروم و... توسط اکسیژن هوا اکسید شده و اسید استیک تولید میکند.
{۲CH_۳CHO + ۲O_۲ → ۲CH_۳COOH}
محصولات جانبی تولید شده در این واکنش مانند اسید فرمیک یا استات اتیل و... به دلیل داشتن نقطه جوش پایینتر از اسید استیک توسط تقطیر جداسازی میشوند. کاربرد اسید استیک به صورت سرکه به عنوان چاشنی غذا و تهیه انواع ترشی استفاده میشود. اسید استیک رقیق به عنوان افشانه برای از بین بردن قارچهای گیاهان استفاده میشود. اسید استیک گلاسیال در صنایع شیمیایی در تولید فیلمهای عکاسی، تولید پلاستیک پلیاتیلن تریفتالات (PETT) استفاده میشود. همچنین به عنوان ماده واسطه در تولید استات وینیل که ترکیب مهمی در تولید چسب و رنگ میباشد،
کربندارکردن متانول
بیشتر اسید استیک جهان به روش کربندار کردن متانول تولید میشود. در این فرایند، متانول و مونو اکسید کربن با یکدیگر واکنش میدهند تا بر اساس معدله شیمیایی زیر اسید استیک تولید شود:
متانول|CH۳OH+مونواکسید کربن |CO→ CH۳COOH
این فرایند که در آن یودو متان به عنوان میانجی مورد استفاده قرار میگیرد، در سه مرحله اتفاق میافتد. یک کاتالیزور که عمدتاً یک کمپلکس است برای کربندار کردن مورد استفاده نیاز است. (گام ۲)
(۱)CH۳OH+ یودید هیدروژن|HI→یودومتان|CH۳I + H۲O
(۲) CH۳I + مونواکسیدکربن |CO → CH۳COI
(۳) CH۳COI + H۲O → CH۳COOH + HI
با تغییر شرایط فرایند، میتوان در همان کارخانه آنیدرید استیک تولید کرد. از آنجاکه هم متانول و هم مونواکسیدکربن مواد خام مناسبی هستند، کربندارکردن متانول از درباز به عنوان یکی از بهترین روشها برای تولید اسید استیک به شمار میآمدهاست. در سال ۱۹۲۵، هنری درفیوس از سلانس بریتانیا یک کارخانه موازی کربندارکردن متانول را تاسیس کرد.[۱۰] با این حال نبود مواد کاربردی که بتوانند در فشارهای بالای مورد نیاز (۲۰۰۰ (واحد)اتمسفر یا بیشتر) حاوی مخلوطهای واکنشی خورنده باشند، باعث شد برای مدتی تمایل به تجاریسازی این روشها از بین برود.
اولین فرایند تجاری کربندارکردن متانول که در آن از کوبالت به عنوان کاتالیزور استفاده میشد، در سال ۱۹۶۳ توسط شرکت صنایع شیمیایی BASF انجام گرفت. در سال ۱۹۶۸، یک کاتالیزور رودیومی (cis−[Rh(CO)۲I۲]−) که میتوانست در فشارهای پایین بدون تولید هیچ فراورده جانبی عمل کند کشف شد. اولین کارخانهای که از این روش استفاده کرد، در سال ۱۹۷۰ توسط شرکت صنایع شیمیایی مونسانتو آمریکا ساخته شد و از آن پس، کربندارکردن متانول با کاتالیزور رودیومی به روش غالب در تولید اسید استیک تبدیل شد. (همچنین رجوع کنید به فرایند مونساتو). در اواخر دهه نود، شرکت صنایع شیمیایی بیپی استفاده تجاری از کاتالیزور کاتیوا ([Ir(CO)۲I۲]−) را که بوسیله روتنیم ارتقا یافته بود آغاز کرد. این فرایند که کاتالیزور آن ایریدیوم است طبیعتدوستتر و کارآمدتر است[۱۱] و تا حد زیادی جای فرایند مونسانتو را در همان کارخانه گرفتهاست.
اکسایش استالدئید
پیش از تجاری شدن روش مونسانتو، بیشتر اسید استیک از طریق اکسایش استالدئید تولید میشد. این روش به عنوان دومین روش مهم تولید پابرجا ماندهاست، هر چند که کربندارکردن متانول در آن، چندان مقرون به صرفه نیست. استالدئید را میتوان از طریق اکسایش بوتان یا نفتا یا آبدار کردن اتیلن بدست آورد.
وقتی بوتان یا نفتای سبک در مجاورت یونهای مختلف فلزی از جمله یونهای منگنز، کوبالت، کرومیوم، پروکسید حرارت میبینند تجزیه میشوند تا براساس معادله شیمیایی زیر اسید استیک تولید کنند.
۲ بوتان|C۴H۱۰ + ۵ اکسیژن|O۲ → ۴ CH۳COOH + ۲ آب|H۲O
معمولاً، این واکنش در تلفیقی از حرارت و فشاری انجام میشود که در عین نگهداری بوتان در حالت مایع، دما را تا حد ممکن بالا نگه دارد. شرایط واکنشی معمولاً در دمای ۱۵۰ درجه سانتیگراد و فشار  ؛ اتمسفر ۵۵ قرار دارد. ممکن است در این میان چند فراورده جانبی نیز تولید شوند از جمله بوتانون، استات اتیل، اسید فورمیک و اسید پروپونیک. این فراوردههای جانبی از لحاظ تجاری با ارزش هستند و در صورتیکه از لحاظ اقتصادی مورد نیاز باشند، شرایط واکنش را تغییر می.دهند تا مقادیر بیشتری از این فراوردهها بدست آید. در عین حال جداسازی اسید استیک از این فراوردههای جانبی ممکن است هزینههای فرایند را افزایش دهد.
تحت شرایط مشابه و با استفاده از کاتالیزورهای یکسان، همانگونه که در اکسایش بوتان صورت میگیرد، میتوان در هوا، استالدئید را برای تولید اسید استیک، توسط اکسیژن اکسید کرد.
۲ استالدئید|CH۳CHO + اکسیژن|O۲ → ۲ CH۳COOH
با استفاده از کاتالیزورهای جدید، میتوان از این واکنش بیش از ۹۵ درصد اسید استیک بدست آورد. فراوردههای جانبی این واکنش عبارتند از استات اتیل، اسید فورمیک و فورمالدئید که همه آنها نسبت به اسید استیک نقطه جوش پایینتری داشته و به راحتی میتوان از طریق تقطیر آنها را جداسازی کرد.
اکسایش اتیلن
تخمیر
؛ تخمیر اکسایشی
در بیشتر تاریخ بشری، اسید استیک در حالت سرکه، توسط گروه باکتریایی «بچه سرکه» ساخته میشدهاست. درصورت وجود اکسیژن کافی، این باکتری میتواند از انواع مختلف مواد غذایی الکلدار، سرکه تولید کند. شاخصترین این غذاها عبارتند از آب سیب، شراب و مخمر غلات|حبوبات، مالت، برنج، یا مالت سیبزمینی. کلیت واکنش شیمیاییای که توسط این باکتری تسهیل میشود عبارتست از
اتانول|C۲H۵OH + اکسیژن|O۲ → CH۳COOH + آب|H۲O
محلول رقیق الکل که با «مخمر سرکه» آغشته شده باشد، در یک محیط گرم هوادار، طی چند ماه به سرکه تبدیل میشود. روشهای صنعتی تولید سرکه، با افزایش تامین اکسیژن برای باکتری، این فرایند را تسریع میکنند.
احتمالاً اولین سرکهها، در پی اشتباه در فرایند شرابگیری تولید شدهاند. اگر فراین تخمیر در حرارت بالا انجام گیرد، بچه سرکه بطور طبیعی مخمر انگور را میپوشاند. با افزایش تقاضای سرکه برای مصارف آشپزی، پزشکی و بهداشتی، شرابفروشان خیلی سریع یاد گرفتند تا چگونه در ماههای گرم پیش از آنکه انگورها برای تبدیل به شراب به اندازه کافی برسند، سایر مواد آلی را برای تولید سرکه مورد استفاده قرار دهند. از آنجا که شرابفروشان از چگونگی این فرایند آگاهی لازم را نداشتند، این روش کند و گاهی ناموفق بود.
یکی از اولین روشهای مدرن «روش سریع» یا «روش آلمانی» است که برای اولین بار در سال ۱۸۲۳ در آلمان بکار گرفته شد. در این فرایند، تخمیر در یک برج بستهبندی شده با تراشههای چوب یا زغال چوب صورت میگیرد. غذای الکلدار از بالای برج پاشیده میشود و اتمسفر زمین|هوای تازه یا بطور طبیعی یا بصورت تبادل حرارت اجباری از پایین تامین میشود. در این فرایند، تامین بهتر هوا، زمان تهیه سرکه را از چند ماه به چند هفته کاهش میدهد.
امروزه بیشتر سرکهها در تانکرهای کشت میکروبیولوژیکی|کشت که در زیر آب غوطهور هستند تهیه میشوند. این روش برای اولین بار در سال ۱۹۴۹ توسط اوتو هروماتکا و هنریخ ابنر ابداع شد. در این روش، الکل در یک تانکر که بطور مداوم محتویات آن به هم میخورد، به سرکه تخمیر میشود و اکسیژن نیز از طریق عبور حبابهای هوا از درون محلول تامین میشود.
؛ تخمیر بدون اکسیژن
برخی گونههای باکتریهای بیهوازی از جمله چندین نوع از دسته «کلاستریدیوم» قادرند بطور مستقیم و بدون استفاده از اتانول به عنوان میانجی، شکرها را به اسید استیک تبدیل کنند. کلیت واکنش شیمیایی که توسط این باکتری انجام میشود عبارتست از:
گلوکوز|C۶H۱۲O۶ → ۳ CH۳COOH
جالبتر اینکه، از نظر شیمیدانان صنعتی، این باکتریهای بیهوازی| بیهوازیها میتوانند اسید استیک را از ترکیبات تک کربنی نظیر متانول، مونواکسیدکربن یا مخلوط دیاکسید کربن و هیدروژن تولید کنند:
۲دیاکسید کربن |CO۲+۴هیدروژن|H۲→ CH۳COOH + ۲ آب|H۲O
توانایی «کلوستریدیوم» در بهکارگیری مستقیم شکر، یا تولید اسید استیک از مواد کم هزینهتر بدین معناست که این نوع از باکتری بطور بالقوه میتواند نسبت به اکسایندگان اتانول نظیر «بچه سرکه»، در تولید اسید استیک کارآمدتر باشد. با این حال، باکتری «کلاستریدیوم» نسبت به «بچه سرکه» در مقابل اسید مقاومت کمتری دارد. حتی در مقایسه با برخی انواع بچه سرکه که میتوانند با غلط ۲۰ درصدی اسید استیک سرکه تولید کنند، مقاومترین انواع «کلاستریدیوم» تنها میتوانند چند درصد اسید استیک در سرکه تولید کنند. در حال حاضر برای تولید سرکه، استفاده از «بچه سرکه» نسبت به استفاده از «کلاستریدیوم» و سپس تغلیظ آن، مقرون به صرفهتر است. در نتیجه با وجودی که باکتریهای استوژنیک از سال ۱۹۴۰ کشف شدهاند استفاده صنعتی از آنها به تعدادی کاربرد بی خطر محدود شدهاست.
کاربردها

بطری 5/2 لیتری اسید استیک در آزمایشگاه
تولید بسیاری از بسیاری از ترکیبات شیمیایی، اسید استیک به عنوان یک واکنشگر شیمیایی به کار میآید. مهمترین کاربرد خاص اسید استیک در تولید استات وینیل تکپاره است، که بلافاصله پس از آن آنیدرید استیک و استر تولید میشود. میزان اسید استیک مورد استفاده در سرکه به نسبت اندک است.
استات وینیل تکپاره
کاربرد اصلی اسید استیک در تولید استات وینیل تکپاره (VAM) است. بین ۴۰ تا ۴۵ درصد از اسید استیک تولید شده در جهان، به مصرف این کاربرد میرسد. این واکنش که کاتالیزور آن پالادیوم است، اتیلن، اسید استیک و اکسیژن تولید میکند.
۲ H۳C-COOH + ۲ اتیلن|C۲H۴ + اکسیژن|O۲ → ۲ استات وینیل |H۳C-CO-O-CH=CH۲ + ۲ آب (مولکول)|H۲O
استات وینیل میتواند به استات پلی وینیل یا سایر پولیمرها، پولیمریزه شود که این مواد در رنگها و چسبها کاربرد دارند.
تولید استر
مهمترین استرهای اسید استیک در تولید جوهر و رنگ و پوشش استفاده می شوند. استرها شامل انیل استات و نرمال بوتیل استات و ایزو بوتیل استات و پروپیل استات می شوند. آنها معمولاً توسط واکنش کاتالیستی ار اسید استیک و الکل تولید می شوند.
بیشتر استرهای استات، از استالدهید با استفاده از واکنش تیشچنکو تولید می شود. علاوه بر این، استات ها اتر به عنوان حلال برای نیترو سلولز، لاک اکریلیک، لاک الکل زدن به جداکننده ها و لکه های چوب استفاده می شود. اول، مونومرهای گلیکول از اتیلن اکسید یا اکسید پروپیلن با الکل تولید می شوند، که سپس با اسید استیک استری می گردند. سه محصول عمده عبارتند از اتیلن گلیکول اتر استات (EEA)، اتیلن گلیکول مونو بوتیل اتر استات (EBA)، و پروپیلن گلیکول مونو متیل اتر استات، معمولتر به عنوان PGMEA در فرایند تولید نیمه هادی، جایی که آن را به عنوان مقاومت در برابر حلال مورد استفاده شناخته شده است . این مصرف حدود 15 ٪ تا 20 ٪ از اسید استیک در سراسر جهان را شامل می شود. اتر استات ها به عنوان مثال EEA، نشان داده شده است به عنوان عوامل مضر برای تولید مثل انسان است.
آنیدرید استیک
محصول مایعسازی دو مولکول اسید استیکآنیدرید استیک است. تولید جهانی آنیدرید استیک اصلیترین کاربرد است که بین ۲۰ تا ۳۰ درصد از تولید اسید استیک در جهان را به مصرف خود میرساند. آنیدرید استیک را میتوان بطور مستقیم از #کربندار کردن متانول|کربندار کردن متانول در مجاورت اسید تولید کرد و میتوان کارخانههای کاتیوا| فرایند کاتیوا را برای تولید آنیدرید تطبیق داد.
آنیدرید استیک، یک عامل قوی اسیددار کردن است. با داشتن چنین خاصیتی، کاربرد اصلی آن در تولید [ترموپلاستیک سلولزی است که به عنوان یک بافت مصنوعی در فیلم عکاسی بکار میرود. همچنین آنیدرید اسید در تولید آسپرین، هرویین و سایر ترکیبات به عنوان واکنشگر عمل میکند.
سرکه
نوشتار اصلی: سرکه
در حالت سرکه و نیز در نمکسود کردن سایر سبزیجات، محلولهای اسید استیکی (معمولاً ۵ تا ۱۸ درصد اسید استیک، با درصدی که معمولاً بر حسب جرم محاسبه میشود) بطور مستقیم به عنوان یک چاشنی مورد استفاده قرار میگیرند. سرکه خانگی اغلب رقیقتر است (۵ تا ۸ درصد اسید استیک)، ولی در نمکسود کردن غذاها برای مصارف تجاری، محلولهای غلیظ تری مورد استفاده قرار میگیرد. میزان اسید استیکی که در سطح جهانی برای تولید سرکه مورد استفاده قرار میگیرد زیاد نیست اما از دیر باز این ماده یکی از پر کاربردترین مواد در تولید سرکه بودهاست.
کاربرد به عنوان حلال
همانگونه که گفته شد اسید استیک# خواص شیمیایی|بالا، اسید استیک منجمد یک حلال پروتوندار قطبی بسیار عالی است. این ماده اغلب در تصفیه مواد آلی به عنوان حلال کریستالسازی مجدد بکار میرود. اسید استیک ذوب شده خالص در تولید اسید ترفتالیک که ماده خام پلی اتیلنترفتالیک (PET)است، به عنوان حلال بکار میرود. اگر چه در حال حاضر این کاربرد ۵ تا ۱۰ درصد از اسید استیک تولید شده در جهان را مصرف میکند، با افزایش تولید PETT انتظار میرود این کاربرد افزایش بیشتری پیدا کند.
در واکنشهایی همچون فریدل کرافتس# اکلیلدار کردن فریدل کرافتس| اکلیلدار کردن فریدل کرافتس که در آنها کربوکاتیون وجود دارد، اسید استیک به عنوان یک حلال بکار میرود. به عنوان مثال، یک مرحله از تولید تجاری کافور مصنوعی، شامل نوآرایی ونگر میروین کمفین به استات ایزوبورنیل است؛ در این حالت اسید استیک برای حفظ کربندار کردن واکنش نوآرایی|بازآراسته، هم به عنوان حلال و هم به عنوان یک هسته دوست عمل میکند. در هنگام کاهش|اکسایش یک گروه نیترو آریل به یک آنیلین با استفاده از پالادیوم کربنی، اسید استیک به عنوان حلال انتخابی استفاده میشود.
در شیمی تحلیلی، اسید استیک منجمد برای تخمین مواد قلیایی ضعیف همچون آمیدهای آلی بکار میرود. اسید استیک منجمد به عنوان باز (شیمی)| باز از آب هم ضعیفتر است در نتیجه در این میانجی، آمید به عنوان یک باز قوی عمل میکند. سپس با استفاده از یک محلول در اسید استیک منجمد با خاصیت اسیدی بسیار قوی همچون اسید پرکلورید، میتوان عیار آنرا اندازه گرفت.
سایر کاربردها
محلولهای رقیق اسید استیک، همچنین به خاطر خاصیت اسیدی ملایم آنها، مورد استفاده قرار میگیرند. در محیط خانگی، استفاده در آبگونه اسیدی ظهور فیلم و برداشتن جرم شیرآب و کتری از نمونههای آن است. خاصیت اسیدی همچنین از طریق سلولهای نیش ستاره دریایی، در درمان نیشستاره دریایی جعبهای استفاده میشود که این کار از آسیبهای جدی و یا حتی مرگ جلوگیری میکند. این خاصیت همچنین در درمان افراد مبتلا به آماس گوش| عفونت گوش خارجی به کار می.رود. همچنین در سیلوی خوراک دام، برای جلوگیری از رشد باکتریها و قارچها، بصورت افشانه از اسید استیک استفاده میشود. محلولهای رقیق اسید استیک می تواند در آزمایشگاه بالینی برای تشخیص تعداد گلبولهای قرمز و سفید استفاده شوند. یکی دیگر از استفاده های بالینی برای lysingg سلول های قرمز خون است، که می تواند ترکیبات مهم دیگر در ادرار را در هنگام آزمایش میکروسکوپی شناسایی کند. اسیدیته آن همچنین برای درمان نیش عروس دریایی کاربرد دارد و اگر فوراً استفاده شود از جراحات حاد و حتی مرگ جلو گیری می کند. و برای درمان عفونت گوش خارجی استفاده می شود. در این روش، اسید استیک به صورت افشانه بر برای علوفه دام به عنوان نگهدارنده افشانده می شود، تا رشد باکتری و قارچ تضعیف شود. اسید استیک آبی همچنین به عنوان یک حذف کننده زگیل و گندمه استفاده می شود از اسید استیک چندین نمک آلی و غیر آلی تولید میشود، از جمله:
استات سدیم__ در صنعت نساجی و نیز به عنوان نگهدارنده غذایی (E number|E۲۶۲).
استات مس ۲__ به عنوان رنگدانه و قراچکش
استات آلومینیوم و استات آهن ۲__ به عنوان ثابتکننده رنگ
استات پلادیوم ۲__ به عنوان کاتالیزور در واکنشهای جفتساز، همچون واکنش هک
استات نقره در حشره کشها
کنترل و از بین بردن کنه واروا در زنبور عسل
اسید استیکهای جایگزین تولید شده عبارتند از:
اسید مونوکلرواستیک. MCA، اسید دیکلرو استیک (به عنوان محصول فرعی) و تری کلرواستیک. MCA در تولید رنگ نیل استفاده میشود.
اسید برومو استیک، که برای تولید واکنشگر برومو استات اتیل استری میشود.
اسید تری فلوئورواستیک که در ترکیبات عالی، یک واکنشگر رایج است.
مقادیر اسید استیکی که در سایر کاربردها بکار میرود (بجز TPA)، ۵ تا ۱۰ درصد از اسید استیک مورد استفاده درسطح جهان را به خود اختصاص دادهاست. در عین حال، انتظار نمیرود این کاربردها به اندازه تولیدTPA، رشد کند.
ایمنی
اسید استیک غلیظ خورندهاست و در نتیجه باید با احتیاط با آن کار کرد، زیرا باعث سوختگی، آسیبهای دائم چشمی و سوزش اعضای دارای مایعات مخاطی میشود. این تاولها و آبلهها ممکن است تا چند ساعت پس از در معرض قرار گرفتن پدیدار نشوند. به هنگام کار کردن با این ترکیبها باید از دستکشهای مقاوم از جنس پلاستیک نیتریل استفاده کرد چراکه استفاده از دستکشهای لاتکس از ایمنی لازم برخوردار نیست. اسید استیک غلیظ در شرایط آزمایشگاهی به سختی مشتعل میشود. با بالا رفتن دما از مرز ۳۹ درجه سانتیگراد، ریسک تبدیل شدن آن به یک ماده منفجره در مجاورت هوا افزایش مییابد. (حد انفجار: ۴/۵ درصد تا ۱۶۶ درصد).
خطر محلولهای اسید استیک به میزان غلظت آن بستگی دارد. محلولهایی که اسید استیک آنها بیش از ۲۵ درصد است، به خاطر بوی زننده و بخار خورنده آنها در هود بخار نگهداری میشود. اسید استیک رقیق به شکل سرکه بی ضرر است. با اینحال وارد کردن محلولهای قویتر در آن، برای انسان و حیوانات ضرر دارد. این محلول به سیستم گوارش آسیب زده و تغییری مهلک را در خاصیت اسیدی خون ایجاد میکند.
به دلیل عدم تطبیق آن، پیشنهاد می شود که اسید استیک را از اسید کرومیک و اتیلن گلایکول و اسید نیتریک و اسید پر کلریک و پرمنگنات ها و پر اکسید ها و هیدروکسیل ها دور نگه دارید.
جستارهای وابسته
سرکه
نمکسود کردن، روشی برای نگهداری غذا
باکتری اسید استیک، تولید سرکه از محلولهای الکلی
اسید استیک (صفحه دادهها)
بچه سرکه، یک دسته مهم از باکتریهای اسید استیک
عامل پوستهزدایی، اغلب حاوی اسید استیک
؛ شیمی
مواد شیمیایی معمولی، محل خرید مواد شیمیایی مورد استفاده در آزمایشها
اسید کربوکسیلیک، هستند-COOH ترکیباتی که حاوی گروه
اسید چرب، زنجیره مستقیم اسید کربوکسیلیک * استات آنیون، CH۳COO−، بطر خلاصه ‘’AcO−’’
گروه استیل، گروه CH۳-CO–، بطور خلاصهAc
کوآنزیم استیلA، یک حامل مهم استیل در سلولها
؛ مواد شیمیایی مرتبط
اسید فورمیک، اسید کربوکسیلیک با یک اتم کربن کمتر به ازای هر مولکول
اسید پروپیونیک، اسید کربوکسیلیک با یک اتم کربن بیشتر به ازای هر مولکول
اتانول، اتیل الکل
استالدئید
استیک آنیدرید
استات اتیل، یک حلال مهم
اسید مونو کلرو استیک
اسیدهای کلرواستیک
پرمنگنات پتاسیم
تاسیم پرمنگنات ترکیبی معدنی است با فرمول شیمیایی KMnO۴. نمک آن از یونهای K+ و MnO۴- تشکیل شده است. سابقاً به آن پرمنگنات و پتاش هم میگفتند. پرمنگنات یک مادهٔ اکسندهٔ بسیار قوی است. در آب نیز محلول است و محلولی به رنگ ارغوانی تولید میکند که از تبخیر آن بلورهای منشوری و درخشان به رنگ ارغوانی بسیار تیره (مایل به سیاه) بر جای می ماند. در این ترکیب منگنز با عدد اکسایش ۷+ حضور دارد. توجه: این ماده با گلیسرین واکنش شدیدی میدهد،هیچگاه این دو ماده را کنار هم انبار نکرده و روی یک دیگر نریزید.
محلولی از پتاسیم پرمنگنات در آب درون بالن حجمی
محتویات
۱ساختار و تهیه
۲کاربردها
۲.۱صنایع سینمایی و تلویزیونی
۲.۲تصفیهٔ آب و ضدعفونی
۲.۳کاربردهای زیست پزشکی
۲.۴سنتزهای شیمی آلی
۲.۵تصفیه پسابهای صنعتی
۲.۶عیارسنجی در شیمی تجزیه
ساختار و تهیه
از بلورهایی به شکل اورتورومبیک تشکیل شده که در آن a=910.۵pm و b=572.۰pm و c=742.۵pm است. (a و b و c به ترتیب طول، عرض و ارتفاع دستگاه بلوری اورتورومبیک است.)
همچنین طول پیوند Mn-O در این پیوند برابر ۱۶۲.۹pm است.
تهیهٔ صنعتی پتاسیم پرمنگنات از منگنز دی اکسید است، که خود از سنگ معدن پیرولوسیت به دست می آید. در این روش MnO۲ به دست آمده از پیرولوسیت با پتاسیم هیدروکسید مخلوط شده و در هوا یا در مجاورت پتاسیم نیترات (یک منبع اکسیژن) حرارت داده می شود. در این فرایند پتاسیم منگنات (K۲MnO۴) به دست می آید که در اکسایش الکترولیتی (الکترولیز) در محلول بازی به پتاسیم پر منگنات تبدیل می شود.
| 2 MnO2 + 4 KOH + O2 → 2 K2MnO4 + 2 H2O |
| 2 MnO42– + Cl2 → 2 MnO4– + 2 Cl– |
همچنین پرمنگنات را می توان از اثر دادن سرب دی اکسید (PbO۲) و یا سدیم بیسموتات (NaBiO۳) بر محلول +Mn۲ نیز به دست آورد. از رنگ بنفش روشن حاصل از این واکنش برای تست حضور یا عدم حضور منگنز نیز استفاده می شود.
کاربردها
بسیاری از کاربردهای پتاسیم پرمنگنات بهخاطر خواص اکسیدکنندگی آن است، از اینکه یک اکسید کنندهٔ قوی است و اینکه در این فرایندها محصول فرعی سمی تولید نمیکند. از کاربرد های پرمنگنات پتاسیم می توان به جذب اتیلن اشاره نمود که در پس از برداشت محصولات کشاورزی جهت افزایش عمر انبار مانی می توان اشاره نمود.
صنایع سینمایی و تلویزیونی
در صنایع سینمایی و تلویزیونی، پتاسیم پرمنگنات یکی از مواد شیمیایی اصلی برای کهنه کردن مجموعهٔ لباسها و غیره می باشد. خاصیت اکسید کنندگی پرمنگنات باعث میشود که پارچه ها، طناب ها، چوبها و شیشهها بیش از ۱۰۰ سال قدیمی تر از آنچه هستند به نظر بیایند.
از این روش در تهیهٔ فیلمهایی همچون "تروی"و "ایندیانا جونز" استفاده شده است.
تصفیهٔ آب و ضدعفونی
به عنوان یک اکسید کننده، پتاسیم پرمنگنات میتواند به عنوان یک ضد عفونی کننده به کار رود. برای مثال محلول رقیق پرمنگنات برای درمان برخی زخمها مانند عفونت قارچی پا استفاده میشود.
کاربرد دیگر آن حذف آهن و هیدروژن سولفید (مادهٔ حاصل بوی بد تخم مرغ فاسد شده) و حذف فسفر آب آشامیدنیاست.
کاربردهای زیست پزشکی
همانطور که از KMnO۴ برای ضد عفونی کردن آب استفاده می شود، این نمک به طور تخصصی به عنوان ضد عفونی کننده برای درمان برخی بیماریهای انسان و حیوان نیز استفاده می شود. در بافتشناسی از آن برای سفید کردن ملانین استفاده میشود تا جزئیات بافت تیره رنگ ملانین آشکار شود. از پتاسیم پر منگنات می توان برای متفاوت کردن آمیلوئیدAA از دیگر آمیلوئیدها هم استفاده کرد. (آمیلوئیدها نوعی از پروتئینها هستند که در صورت تجمع بی جا باعث بیماریآمیلوئیدوز می شوند، برای اطلاعات بیشتر واژهٔ Amyloid را در ویکیپدیای انگلیسی ببینید) پتاسیم پرمنگنات باعث میشود که آمیلوئیدAA به وسیلهٔ رنگ سرخ کنگو (congo redd) رنگ آمیزی نشود، این در حالی است که دیگر آمیلوئیدها به وسیلهٔ سرخ کنگو رنگ می شوند. در یک بازهٔ زمانی از پتاسیم پرمنگنات برای درمان سوزاک استفاده شد و همچنین از آن هنوز در درمان برفک استفاده می شود.
سنتزهای شیمی آلی
مهمترین و بزرگترین کاربردهای پتاسیم پرمنگنات، استفاده از آن به عنوان واکنشگر در سنتز برخی مواد آلی بروش اکسایش است. مثلاً ترکیباتی بنزوآلکیل به اسیدها اکسید می شوند. همچنین بهوسیله پرمنگنات آلکنها را به گلیکولها تبدیل میکنند.
تصفیه پسابهای صنعتی
بهدلیل خاصیت اکسیدکنندگی قوی و قیمت ارزان، در تصفیه پسابهای صنعتی است.
عیارسنجی در شیمی تجزیه
یکی از روشهای مرسوم در تعیین غلظت مواد در صنعت عیارسنجی یا تیتراسیون است. عیارسنجی ها خود بر چند قسم چون پیچیده سنجی و اکسایش - کاهش هست. در عیارسنجی های اکسایش - کاهش یکی از معرفهای پرکاربرد پرمنگنات است که بهدلیل رنگ بنفش خود، نیاز به شناساگر هم ندارد. از این ترکیب برای عیارسنجی ترکیبهایی چون آب اکسیژنه و آهن (II) استفاده میشود.
الومینیوم سولفات مشخصات
آلومینیوم سولفات(به انگلیسی: Aluminium sulfate)که بدین شکل نوشته میشود Al2(SO4)3 یا Al2O12S3، یک ترکیب شیمیایی با شناسه پابکم ۲۴۸۵۰ است. که جرم مولی آن ۳۴۲٫۱۵ g/mol میباشد. شکل ظاهری این ترکیب، جامد بلوری سفید است.
فرایند تولید
تولید سولفات آلومینیوم طی فرایندی از واکنش اسید سولفوریک و محلول آبدار حاوی آلومینا یا همان هیدروکسید آلومینیوم انجام می شود. روند واکنش طی یک جریان پیوسته که در دمای کنترل شده 225 تا 260 درجه فارنهایت و در فشار خاصی نگهداری می شود و در محفظه واکنش انجام می گیرد. اسید سولفوریک و محلول آلومینا از محفظه واکنش طی زمانی بین 5 تا 45 دقیقه عبور داده می شوند که برای دستیابی به 78 تا 100 درصد تکمیل واکنش کافی می باشد. سپس مواد واکنش دهنده در اثر قرار گیری در یک میکسر که از یک مارپیچ تغییر جهت دهنده تشکیل شده است, با هم مخلوط شده و ترکیب سولفات آلومینیوم نهایی بدست می آید.
2Al(OH)3+3H2SO4→Al2(SO4)3+6H2O
و یا با حرارت دادن فلز آلومینیوم در محلول اسید سولفوریک:
(2Al(s)+3H2SO4→Al2(SO4)3+3H2(g
کاربرد های آلومینیوم سولفات
حدود 50% از سولفات آلومینیوم در کاغذ سازی و کارتون سازی و مقواسازی استفاده می شود. همچنین از سولفات آلومینیوم به دلیل سه ظرفیتی بودن یون آلومینیوم و توانایی بالای آن در انعقاد و لخته سازی ذرات کلوئیدی، در تصفیه ی آب و فاضلاب استفاده می شود. سولفات آلومینیوم به دلیل ترکیب شدن یون آلومینیوم با هالوژن هایی نظیر کلر و فلوئور و ایجاد رسوب و کمک به حذف آن ها از محلول سولفات روی حاصل از لیچینگ خاک یا کنسانتره ی روی، جهت جلوگیری از چسبندگی فلز روی به کاتد ها در صنعت تولید روی مصرف می شود.http://elikacompany.com/?post_type=product&p=23
| شناساگرها | |
|---|---|
| شماره ثبت سیایاس | 10043-01-3 |
| شمارهٔ ئیسی | 233-135-0 |
| شمارهٔ آرتیئیسیاس | BD1700000 |
| خصوصیات | |
| فرمول مولکولی | Al2(SO4)3·16H2O |
| جرم مولی | 342.15 g/mol as anhydrous salt |
| شکل ظاهری | white crystalline solid |
| چگالی | 2.672 g/cm³ solid |
| دمای ذوب | 770 °C decomp. |
| انحلالپذیری در آب | 870 g/L |
| ساختار | |
| ساختار بلوری | دستگاه بلوری مونوکلینیک(hydratee) |
| ترکیبات مرتبط | |
| دیگر کاتیونها | گالیوم سولفات منیزیوم سولفات |
| ترکیبات مرتبط | نگاه کنید به آلوم |
اکسید روی مشخصات
روی اکسید یا اکسید روی (به انگلیسی: ZINC OXIDE) که در کتابهای کهن توتیا نامیده میشود، ترکیب غیر آلی با فرمول ZnO و به شکل پودری سفید رنگ و غیرمحلول در آب است.
محتویات
۱کاربردها
۲مصارف صنعتی
۳مصارف دارویی
۴مصارف آرایشی
۵تولید
۶جستارهای وابسته
۷منابع
کاربردها
مصارف صنعتی
این ترکیب در ساخت مواد فراوانی در صنعت مانند پلاستیک، سرامیک، شیشه، سیمان، لاستیک (تایر اتومبیل)، نرم کننده، رنگها، مومها، چسب، غذاها، باتری و... استفاده میشود.پودر اکسید زینک کاربردهای فراوانی دارد.کاربردهای اصلی آن به صورت خلاصه ارائه میشود.بیشتر کاربردها از واکنش اکسید روی به عنوان ماده تشکیل دهنده سایر اجزای روی استفاده میکنند. کاربرد آن در علم مواد شامل ضریب شکست بالا، رسانایی حرارتی بالا، آنتی بیوتیک و مواد محافظ اشعه UV میباشد. به طریق مشابه به موادی مثل پلاستیک، سرامیک، شیشه، چوب، سیمان، رنگ، گریس، پماد، چسب، مهر، رنگ دانه، باتری، مدار به کار رفته در اطفاع حریق و بسیاری موارد دیگراستفاده میشود.
مصارف دارویی
در پزشکی و بهداشت این ترکیب با نام زینک اکساید در پودر بچه، پمادهای پوستی، کرم ضد آفتاب، شامپو ضدشوره و... استفاده میشود. پماد زینک اکساید در درمان ضایعات پوستی مستعد عفونت مانند سوختگی، اگزما، سوختگی پای نوزادان، خراشیدگی و گزش حشرات. ضد التهاب خفیف پوستی و همچنین در ترکیب کالامین به عنوان ضد خارش کاربرد دارد.
اکسید روی دارای خواص مرطوب کننده، آنتی بیوتیکی و دئودورانت است. به دلیل آثار ضد سبوم و منعکس کننده اشعه UV در ترکیب کرمهای ضد آفتاب نیز استفاده میشود.
مصارف آرایشی
اکسید روی مصارف فراوانی در صنایع آرایشی دارد. این ترکیب می تواند اشعه UV خورشید را جذب کرده و از پوست در مقابل آفتاب سوختگی و سایر خسارات اشعه UV محافظت نماید.
اکسید روی یکی از مهمترین ترکیبات مواد آرایشی معدنی است. از آنجا اکسید روی توسط پوست قابل جذب نیست بنابراین باعث هیچ گونه حساسیت پوستی نمی شود و غیر حساسیت زا و غیر جوش زا می باشد.
همچنین در تولید دئودورانت ها و صابون ها کاربرد دارد. این ترکیب در حذف بوی بد بدن و جلوگیری از رویش باکتری ها کمک می کند و بخوبی موجب تسکین هر گونه حساسیت پوستی می شود.
تولید
در مصارف صنعتی اکسید روی به مقدار ۱۰۵ تن در سال به سه روش اصلی که در ذیل به آن اشاره میشود تولید میشود.
روش غیر مستقیم: روی(Zn) در ظرف مخصوص ذوب گرافیت ، مایع شده و در دمای بالای ۹۰۷ درجه سانتی گراد به بخار تبدیل میشود. بخار روی با اکسیژن ( O۲)موجود در هوا واکنش نشان داده و اکسید روی(ZnO) تشکیل میشود. روی اکسید تشکیل شده سرد شده و جمع آوری میشود. این روش در سال ۱۸۴۴ توسط LeClaire فرانسوی کشف شد. نتیجه این روش اکسید زینک فشرده با اندازه ۰٫۱ تا چند میکرو متر است. بیشتر اکسید زینک تولیدی در جهان از این روش میباشد.
روش مستقیم:
روش فرایند شیمیایی مرطوب
روی
| خصوصیات | |
|---|---|
| فرمول مولکولی | ZnO |
| جرم مولی | 81.408 g/mol |
| شکل ظاهری | White solid |
| بوی | odorless |
| چگالی | 5.606 g/cm3 |
| دمای ذوب | 1975 °C (decomposes)[۱] |
| دمای جوش |
2360 °C
|
| انحلالپذیری در آب | 0.16 mg/100 mL (30 °C) |
| نوار ممنوعه | 3.3 eV (direct) |
| ضریب شکست (nD) | 2.0041 |
| ترموشیمی | |
|
آنتروپی مولار
استاندارد S |
43.9 J·K−1mol−1 |
|
آنتالپی استاندارد
تشکیل ΔfH |
-348.0 kJ/mol |
| خطرات | |
| MSDS | ICSC 0208 |
| شاخص ئییو | ۰۳۰-۰۱۳-۰۰-۷ |
| طبقهبندی ئییو | Dangerous for the environment (N) |
| کدهای ایمنی | R50/53 |
| شمارههای نگهداری | S60, S61 |
| لوزی آتش |
 |
| نقطه اشتعال | 1436 °C |
| ترکیبات مرتبط | |
| دیگر آنیونها | روی سولفید سلنید روی تلورید روی |
| دیگر کاتیونها | کادمیم اکسید جیوه(II) اکسید |
منیزیم سولفات مشخصات
منیزیم سولفات (به انگلیسی: Magnesium sulfate) با فرمول شیمیایی MgSO۴
رده درمانی: املاح
اشکال دارویی: آمپول و شربت
محتویات
۱موارد مصرف در پزشکی
۲موارد مصرف در کشاورزی
۳مکانیسم اثر سلولی
۴عوارض جانبی
۵جستارهای وابسته
۶منابع
موارد مصرف در پزشکی
سولفات منیزیم تزریقی جهت پیشگیری از تشنج در پره اکلامپسی، زایمان زودرس و بندرت در درمان آریتمیهای قلبی مصرف میشود. به صورت تزریقی و خوراکی نیز در درمان هیپومنیزیمی استفاده شده است. به عنوان گشادکننده برونش نیز مطرح است. محلول خوراکی آن مسهل اسموتیک رایجی است.
موارد مصرف در کشاورزی
به عنوان کود شیمیایی در خاکهایی که کمبود منیزیم دارند استفاده میشود.
مکانیسم اثر سلولی
۱- مهارآزاد سازی استیل کولین درمحل اتصال عصب – عضله
۲- مهار داخل شدن Ca به سلولهای میومتر (اثرمستقیم)
۳- مانع وارد شدن ca به داخل سلول دراثر افزایش منیزیوم داخل سلولی که این اثر وابسته به دوزاست ودرغلظتmeq ۱۰-۸ روی میدهد.
۴- اثر ضد تشنج دراثر بلوک نورونی Ca ازطریق کانال گلوتامات است (این کانالها فقط در CNS وجوددارند) واثر ضد تشنجی روی کورتکس مغز است. اثر ضدتشنجی بدون ایجاد دپرسیون CNS درمادر و جنین است.
عوارض جانبی
ازبین رفتن رفلکسهای تاندونی عمقی – دپرسیون تنفسی – تهوع واستفراغ – گرگرفتگی – احساس تشنگی – هیپوتانسیون – خواب آلودگی – گیجی – ضعف عضلانی – برادی کاردی – کوما. وقتی سطوح پلاسمایی به بالاتر از حد درمانی برسد ابتدا رفلکسهای پاتلار از بین میروند. این امر نشان دهنده مسمومیت قریبالوقوع با منیزیم است. درغلظت ۱۲meq<فلج تنفسی رخ میدهد.
درمان دپرسیون تنفسی ۱gr گلوکونات کلسیم داخل رگی همراه با قطع سولفات منیزیم است بایددانست که اثر گلوکونات کلسیم کوتاه مدت است وممکنست به دوزهای مکرر نیاز پیدا کنیم و انتوباسیون تراکئال وتهویه مکانیکی در دپرسیون شدید انجام میشود. دپرسیون تنفسی نوزاد نیز ممکن است.
جستارهای وابسته[ویرایش]
پرهاکلامپسی
| شناساگرها | |
|---|---|
| شماره ثبت سیایاس | ۷۴۸۷-۸۸-۹ |
| پابکم | ۲۴۰۸۳ |
| کماسپایدر | ۲۲۵۱۵ |
| UNII | ML30MJ2U7I |
| دراگبانک | DB00653 |
| ChEBI | CHEBI:32599 |
| ChEMBL | CHEMBL۱۲۰۰۴۵۶ |
| شمارهٔ آرتیئیسیاس | OM4500000 |
| کد اِیتیسی | A06,A12CC02 B05XA05D11AX05 V04CC02 |
| جیمول-تصاویر سه بعدی | Image 1 |
| خصوصیات | |
| فرمول مولکولی | MgSO4 |
| جرم مولی | 120.366 g/mol (anhydrous) 246.47 g/mol (heptahydrate) |
| شکل ظاهری | white crystalline solid |
| چگالی | 2.66 g/cm3 (anhydrous) 2.445 g/cm3 (monohydrate) 1.68 g/cm3 (heptahydrate) 1.512 g/cm3 (11-hydratee) |
| دمای ذوب | 1124 °C (anhydrous decomp) 200 °C (monohydrate decomp) 150 °C (heptahydrate decomp) 2 °C (11-hydrate decomp) |
| انحلالپذیری در آب | anhydrous 269 g/L (0 °C) 255 g/L (20 °C) heptahydrate 710 g/L (20 °C) |
| انحلالپذیری | 0.116 g/L (18 °C اتر) slightly soluble in الکلگلیسیرین insoluble in استون |
| ضریب شکست (nD) | 1.523 (monohydrate) 1.433 (heptahydrate) |
| ساختار | |
| ساختار بلوری | دستگاه بلوری مونوکلینیک(hydratee) |
| خطرات | |
| MSDS | External MSDS |
| شاخص ئییو | Not listed |
| ترکیبات مرتبط | |
| دیگر کاتیونها | سولفات برلیوم کلسیم سولفات سولفات استرانسیم باریوم سولفات |
سولفات منگنز مشخصات
منگنز(۲) سولفات(به انگلیسی: Manganese(II) sulfate) یک ترکیب معدنی با فرمول MnSO۴ است.
کاربردهای سولفات منگنز
از سولفات منگنز برای تامین منگنز خاک جهت تغذیه ی گیاهان و در صنایع شیمیایی از جمله در استخراج فلز روی از خاک استفاده می شود. منگنز در خاک به صورت کاتیون دو ظرفیتی قابل جذب است و کمبود آن موجب زردی رگبرگ ها و توقف رشد در سرشاخه ها می شود.
| شناساگرها | |
|---|---|
| شماره ثبت سیایاس | 7785-87-7 |
| خصوصیات | |
| فرمول مولکولی | MnSO4 |
| جرم مولی | Anhydrous 151.00 g/mol
Tetrahydrate 223.07 g/mol |
| چگالی | 2.95 g/cm3 ? |
| دمای ذوب | 700 °C; loses water at 400 ~ 500 °C |
| دمای جوش |
850 °C
|
| انحلالپذیری در آب | 39.3 g/100 mL (24 °C); 26.2 g/100 mL (100 °C) |
روی سولفات مشخصات
روی سولفات(به انگلیسی: Zinc sulfate) (ZnSO4) یک نوع ترکیب معدنی است.
| شناساگرها | |
|---|---|
| شماره ثبت سیایاس | 7733-02-0 |
| پابکم | 24424 |
| جیمول-تصاویر سه بعدی | Image 1 |
| خصوصیات | |
| فرمول مولکولی | ZnSO4 (anhydrous) ZnSO4.7H2O (heptahydrate) |
| جرم مولی | 161.472 (anhydrous) [۱] 287.579 (heptahydrate) [۱] |
کلرید پتاسیم مشخصات
ترکیب شیمیایی پتاسیم کلرید (KCl) یک نوع نمک است که از ترکیب پتاسیم و کلر به وجود میآید.
| شناساگرها | |
|---|---|
| شماره ثبت سیایاس | 7447-40-7 |
| خصوصیات | |
| فرمول مولکولی | KCl |
| جرم مولی | 74.551 g/mol |
| شکل ظاهری | کریستال سفید جامد |
| چگالی | 1.987 g/cm3 |
| دمای ذوب | 776 °C |
| انحلالپذیری در آب | 28.1 g/100 cm³ (0سلسیوس);
34.0 g/100 cm³ (20 °C); 56.7 g/100 cm³ (100 °C); |
| خطرات | |
| LD50 | 2600 mg/kg (oral/rat), 142 mg/kg (intravenous/rat)[۱] |
| ترکیبات مرتبط | |
| دیگر آنیونها | پتاسیم فلورید; پتاسیم برومید;پتاسیم یدید |
| دیگر کاتیونها | کلرید سدیم; روبیدیم کلرید |
کلرید روی مشخصات
کلرید روی (به انگلیسی: Zinc chloride) با فرمول شیمیایی ZnCl۲ یک ترکیب شیمیایی با شناسه پابکم ۳۰۰۷۸۵۵ است. که جرم مولی آن 136.315 g/mol میباشد. شکل ظاهری این ترکیب، جامد بلوری سفید است.
نامگذاری اتحادیه بینالمللی شیمی محض و کاربردی
| شناساگرها | |
|---|---|
| شماره ثبت سیایاس | 7646-85-7 |
| پابکم | 3007855 |
| کماسپایدر | 5525 |
| UNII | 86Q357L16B |
| شمارهٔ ئیسی | 231-592-0 |
| شمارهٔ یواِن | 2331 |
| ChEBI | CHEBI:49976 |
| ChEMBL | CHEMBL1200679 |
| شمارهٔ آرتیئیسیاس | ZH1400000 |
| کد اِیتیسی | B05 |
| جیمول-تصاویر سه بعدی | Image 1 |
| خصوصیات | |
| فرمول مولکولی | ZnCl2 |
| جرم مولی | 136.315 g/mol |
| شکل ظاهری | white crystalline solid hygroscopic |
| بوی | odorless |
| چگالی | 2.907 g/cm3 |
| دمای ذوب | ۲۹۲ درجه سلسیوس (۵۵۸ درجه فارنهایت; ۵۶۵ کلوین) |
| دمای جوش |
756 °C, 1029 K, 1393 °F
|
| انحلالپذیری در آب | 4320 g/L (25 °C) |
| انحلالپذیری | soluble in اتانول گلیسیرین andاستون |
| انحلالپذیری درalcohol | 4300 g/L |
| ساختار | |
|
موقعیت
هندسی |
چهاروجهی linear in the gas phase |
| خطرات | |
| MSDS | External MSDS |
| شاخص ئییو | 030-003-00-2 |
| طبقهبندی ئییو | Harmful (Xn) Corrosive (C) Dangerous for the environment (N) |
| کدهای ایمنی | R۲۲, R۳۴, R50/53 |
| شمارههای نگهداری | (S1/2), S26, S36/37/39,S45, S60, S61 |
| لوزی آتش |
 0
3
0
|
| LD50 | 350 mg/kg, rat (oral) |
| ترکیبات مرتبط | |
| دیگر آنیونها | فلورید روی برمید روی یدید روی |
| دیگر کاتیونها | کادمیم کلرید کلرید جیوه(II) |
پتاسیم کربنات مشخصات
| شناساگرها | |
|---|---|
| شماره ثبت سیایاس | 584-08-7 |
| شمارهٔ آرتیئیسیاس | TS7750000 |
| خصوصیات | |
| فرمول مولکولی | K2CO3 |
| جرم مولی | 138.2055 g/mol |
| شکل ظاهری | جامد سفید نمگیر |
| چگالی | 2.29 g/cm3 solid |
| دمای ذوب | 891 °C |
| دمای جوش |
تجزیه میشود.
|
| انحلالپذیری در آب | 112 g/100 mL (20 °C) |
| خطرات | |
| لوزی آتش |
 0
2
0
|
| نقطه اشتعال | غیر مشتعل |
| ترکیبات مرتبط | |
| دیگر کاتیونها | کربنات لیتیم کربنات سدیمکربنات سزیم |
سیانید روی مشخصات
سیانید روی (به انگلیسی: Zinc cyanide) با فرمول شیمیایی C۲N۲Zn یک ترکیب شیمیایی با شناسه پابکم ۱۱۱۸۶ است. که جرم مولی آن ۱۱۷٫۴۴۴ g/mol میباشد. شکل ظاهری این ترکیب، پودر سفید است.
نامگذاری اتحادیه بینالمللی شیمی محض و کاربردی
| Zinc cyanide | |
|---|---|
| شناساگرها | |
| شماره ثبت سیایاس | 557-21-1 |
| پابکم | 11186 |
| کماسپایدر | 10713 |
| شمارهٔ آرتیئیسیاس | ZH1575000 |
| جیمول-تصاویر سه بعدی | Image 1 |
| خصوصیات | |
| فرمول مولکولی | C2N2Zn |
| جرم مولی | 117.444 g/mol |
| شکل ظاهری | white powder |
| چگالی | 1.852 g/cm3 solid |
| دمای ذوب | 800 °C (decomposes) |
| انحلالپذیری در آب | 0.00005 g/100 mL (20 °C) |
| انحلالپذیری | attacked by قلیاییes پتاسیوم سیانید آمونیاک |
| خطرات | |
| طبقهبندی ئییو | not listed |
| لوزی آتش |
 0
4
2
|
| LD50 | 100 mg/kg, rat (intraperitoneal) |
گلوکنات سدیم مشخصات
گلوکونات سدیم (به انگلیسی: Sodium gluconate) یک ترکیب شیمیایی با شناسه پابکم ۸۴۶۸۷ است.
نامگذاری اتحادیه بینالمللی شیمی محض و کاربردی
| شناساگرها | |
|---|---|
| شماره ثبت سیایاس | 527-07-1 |
| پابکم | 84687 |
| کماسپایدر | 76397 |
| ChEMBL | CHEMBL1200919 |
| جیمول-تصاویر سه بعدی | Image 1 |
| خصوصیات | |
| فرمول مولکولی | C6H11NaO7 |
| جرم مولی | ۲۱۸٫۱۴ g mol−1 |
سدیم نیترات مشخصات
سدیم نیترات یک ترکیب شیمایی با فرمول NaNO3 است. معادن زیادی از این نمک در شیلی و پرو قرار دارند این ماده سفید به مقدار زیاد در آب حل میشود. این ماده همچنین نیتراتین نیز نامیده میشد.
این ماده در ساخت تقویتکنندهها، بمب دودی و موارد زیاد دیگر کاربرد دارد.
| خصوصیات | |
|---|---|
| فرمول مولکولی | NaNO3 |
| جرم مولی | 84.9947 g/mol |
| شکل ظاهری | پودر سفید یا کریستال بیرنگ با بویی شیرین |
| چگالی | 2.257 g/cm3 solid |
| دمای ذوب | 308 °C |
| دمای جوش |
380 °C decomp.
|
| انحلالپذیری در آب | 730 g/L (0 °C) 921 g/L (25 °C) 1800 g/L (100 °C) |
| انحلالپذیری | بسیار قابل حل در آمونیاک;قابل حل در الکل |
| ضریب شکست (nD) | 1.587 (trigonal) 1.336 (rhomobohedral) |
| ساختار | |
| ساختار بلوری | trigonal and rhombohedral |
| ترموشیمی | |
|
آنتروپی مولار
استاندارد S |
117 J·mol−1 K−1 |
|
آنتالپی استاندارد
تشکیل ΔfH |
−468 kJ/mol |
| خطرات | |
| MSDS | ICSC 0185 |
| شاخص ئییو | فهرست نشده |
| طبقهبندی ئییو | |
| خطرات اصلی | اکسیدهکننده, تحریککننده |
| لوزی آتش |
 0
1
0
OX
|
| نقطه اشتعال | آتشگیر نیست |
| LD50 | 3236 mg/kg |
| ترکیبات مرتبط | |
| دیگر آنیونها | سدیم نیتریت |
| دیگر کاتیونها | لیتیم نیترات پتاسیم نیترات روبیدیم نیترات سزیم نیترات |
| ترکیبات مرتبط | سدیم سولفات سدیم کلرید |
متابی سولفیت سدیم مشخصات
سدیم متابیسولفیت یا سدیم پیروسولفیت که در سیستم نامگذاری IUPAC، برم. ای. سدیم متابیسولفیت نامیده میشود، یک ترکیب غیر آلی فرمول شیمیایی Na۲S۲O۵ است. این ماده گاهی اوقات به عنوان دی سدیم (metabisulfite) از این ترکیب اکثراً به عنوان یک عامل ضد عفونی کننده، آنتی اکسیدان و نگهدارنده استفاده می شود.
سدیم متابی سولفیت پودر کریستال شده سولفور دی اکسید با چگالی بین 1 تا 1.2 Kg/l است و در دمای بالای 120 °C تجزیه می گردد. اگر محفظه ای که محلول در آن واقع شده کاملاً عایق بندی نشده باشد به سرعت با رطوبت هوا ترکیب شده و اکسیده می گردد. مقدار آب جذب شده توسط محصول در محفظه بسته به میزان نفوذ بستگی دارد که آن نیز به نوبه خود به درجه حرارت و رطوبت نسبی بستگی دارد. در شرایط نگهداری غلط ، ممکن است به تشکیل دانه های سخت در محصول منجر گردد. تمام انواع سدیم متابی سولفایت به راحتی در آب حل می شوند. در محلولهای آبی به شکل سدیم بی سولفیت است.
محتویات
۱آماده سازی
۲ساختار شیمیایی
۳خواص شیمیایی
۴موارد استفاده
۵ایمنی
۶نگهداری و جابجایی
۷منابع
1- آماده سازی
سدیم متابی سولفیت را می توان از تبخیر محلول سدیم سولفیت اشباع شده با گاز دی اکسید گوگرد تهیه نمود:
2 HSO3- ⇌ H2O + S2O52-
که در نهایت Na2S2O5 جامد بجا می ماند.
2- ساختار شیمیایی
آنیون ترکیبی از دی تیونیت (S2O42-) و دی تیونات (S2O62-). است. آنیون شامل گروهی SO2 است که با گروهی SO3 پیوند یافته با بار منفی که در سمت منتهی به SO3 قرار دارد. طول پیوند S-S حدود 2.22 Å و پیوند S-O" تیونیت " و " تیونات " دارای طول 1.46 و 1.50 Å می باشد.
3- خواص شیمیایی
سدیم متابی سولفیت در ترکیب با آب باعث جذب اکسیژن موجود در آب و آزاد شدن گاز دی اکسید گوگرد (SO2) می گردد که باعث ایجاد بوی نامطبوعی گردیده و تنفس را دچار مشکل می نماید . آزاد کردن دی اکسید گوگرد باعث تبدیل سدیم متابی سولفیت به یک عامل کاهنده قوی در آب گشته و به همین دلیل نبایستی در رودخانه ها و دریاچه ها ریخته شود چون بطور جدی باعث مختل شدن زندگی حیوانات و گیاهان می گردد. به همین دلیل میزان استفاده از سدیم متابی سولفیت به شدت کاهش یافته و به جای آن حاملهایی چون پیروکسید هیدروژن با تاثیری مشابه و بدون بو جهت استریلیزاسیون تجهیزات استفاده می گردد.
سدیم متابی سولفیت در ترکیب با اسیدها موجب آزاد شدن دی اکسید گوگرد می گردد :
Na2S2O5 + 2 HCl → 2 NaCl + H2O + 2 SO2
در حرارت بالا نیز این ترکیب دی اکسید گوگرد آزاد کرده و سدیم سولفیت به جا می گذارد :
Na2S2O5 → Na2SO3 + SO2
4- موارد استفاده
- به عنوان یک نگهدارنده و آنتی اکسیدان در مواد غذایی استفاده می شود و هم چنین به عنوان E223 شناخته می شود.
- ( در افرادی که به سولفیتها حساسیت دارند ممکن است باعث بروز واکنشهای آلرژیک ، از جمله واکنشهای تنفسی در افراد مبتلا به آسم ، آنافیلاکسی و سایر واکنشهای آلرژیک، گردد. )
- سدیم متابی سولفایت و پتاسیم متابی سولفایت یکی از مواد اولیه در قرصهای Campden است که در ساخت شراب و آبجو استفاده می گردد.
- مصرف روزانه قابل قبول برای هر کیلو گرم وزن بدن ، 0.7 mg است. سدیم متابی سولفایت عوارض جانبی نداشته و در کبد بوسیله اکسیداسیون به سولفات بی ضرر تبدیل شده و توسط ادرار دفع می گردد.
- در صنایع شیمیایی و دارویی برای مقاصد مختلفی همچون عامل کاهنده در تصفیه و جداسازی آلدئیدها و کتونها ، جهت از بین بردن زباله های حاوی برم حاصل از تهیه رنگ استفاده می گردد.
- جهت حذف کلر اضافی در آب آشامیدنی
- جهت تمیز کردن غشاهای اسمز معکوس آب آشامیدنی در سیستمهای آب شیرین کن
- جهت پاکسازی تجهیزات در آبجوسازی خانگی
- در موارد خاص جهت از بین بردن اکسیژن از آب تغذیه دیگهای بخار آب
- در تصفیه فاضلاب برای مثال از گیاهان آبکاری، جهت خنثی کردن اسید کرومیک جهت حذف کلر اضافه در خنثی سازی سیانیدها
- جهت تمیز کردن و سفید کردن پشم ، جوت و سایر الیافهای گیاهی
- در رنگرزی پارچه و چاپ برای آماده سازی فتس نیلی و حل کردن دیگر رنگها
- جهت حل کردن عصاره های دباغی
- در ساخت کاغذ جهت سفید کردن خمیر چوب
- در صنایع عکاسی و فیلم جهت آماده سازی حلالهای مناسب برای حمام تثبیت کننده اسیدی
- اضافه شده به محلولهای بی حس کننده موضعی ( لیدوکائین و غیره ) جهت جلوگیری از اکسیده شدن آدرنالین تنگ کننده عروق موجود در آنها و در نتیجه افزایش طول عمر محلول
- به عنوان یک excipient در برخی از قرص ها، مانند پاراستامول استفاده می شود. تقریبا 0.5 mg در epinephrine autoinjectors مانند EpiPen استفاده می شود.
- همچنین به منظور رسوب طلا از اسید طلایی (طلا محلول در تیزاب سلطانی) استفاده می شود.
- به عنوان یک عامل سفید کننده در تولید کرم نارگیل استفاده می شود
- به عنوان یک منبع تولید SO2 (مخلوط شده با هوا یا اکسیژن) برای تخریب سیانید در فرآیندهای سیانیداسیون طلا تجاری استفاده می شود.
- یکی از جنبه های بسیار مهم مرتبط با سلامت این ماده آنست که می توان آنرا به لام خون در یک آزمون تشخیص کم خونی داسی شکل ( و یا هر بیماری مشابه دیگر در تغییر شکل هموگلوبین ) اضافه نمود. مواد باعث از بین رفتن سلولهای داسی شکل ( طی یک پلیمریزاسیون پیچیده) شده و بنابر این وجود یا عدم وجود بیماری تایید گردد.
5- ایمنی
اثرات بیولوژیکی :
تمامی نمونه های سدیم متابی سولفیت دارای مقدار کمی SO2 بوده که موجب تحریک چشم و دستگاه تنفسی می گردد. در تماس با اسیدها ممکن است مقادیر خطرناکی از SO2 تولید گردد.
در نمونه های آبی ، سدیم بی سولفیت باعث کاهش شدید اکسیژن شده و ممکن است به موجودات آبزی آسیب برساند.
نکات ایمنی :
- سدیم متابی سولفیت طبق استاندارد جزء مواد خطرناک گنجانیده نگردیده است. بر اساس داده های در دسترس ما ، محصولات سدیم متابی سولفیت بایستی با برچسب مواد مضر Xnو حروف R, S مطابق زیر مشخص گردند:
R41 : خطر ابتلا به آسیبهای جدی به چشم
R37 : تحریک کننده دستگاه تنفسی
R31 : در تماس با اسید آزاد کننده گاز سمی
R22 : در صورت خورده شدن مضر
S26 : در صورت تماس با چشم با مقدار زیادی آب شستشو داده و به پزشک مراجعه گردد.
کلیه نمونه های حاوی سدیم متابی سولفیت در زیر گروه محصولات "خطر تماس با آب" قرار دارند.
6- نگهداری و جابجایی
کلیه نمونه های سدیم متابی سولفیت بایستی در جای خشک و خنک نگهداری گردند. اگر دما از 25°C و رطوبت از 45% تجاوز ننماید تا شش ماه ثابت باقی می مانند. اگر درجه حرارت یا رطوبت از حد تعیین شده بالاتر رود ممکن است باعث کاهش SO2 و تغییر PH محلول گردد. در دمای زیر 10°C به صورت کریستال در می آید.
| خصوصیات | |
|---|---|
| فرمول مولکولی | Na2S2O5 Na-O-(S=O)-O-(S=O)-O-Na |
| جرم مولی | 190.107 g/mol |
| شکل ظاهری | white powder |
| چگالی | 1.48 g/cm3 |
| دمای ذوب | >170 °C (begins at 150 °C) |
| انحلالپذیری در آب | 54 g/100 ml |
| خطرات | |
| MSDS | Mallinckrodt MSDS |
| شاخص ئییو | 016-063-00-2 |
| طبقهبندی ئییو | Harmful (Xn) Irritant (Xi) |
| کدهای ایمنی | R۲۲ R31 R۴۱ |
| شمارههای نگهداری | S۲ S26 S۳۹ S۴۶ |
| لوزی آتش |
 0
2
0
|
| ترکیبات مرتبط | |
| دیگر آنیونها | سدیم سولفیت سدیم بیسولفیت |
| دیگر کاتیونها | پتاسیم متابیسولفیت |
| ترکیبات مرتبط | سدیم دی تیونیت سدیم تیو سولفات سدیم سولفات |
کربنات سدیم مشخصات
سدیم کربنات، Na2CO3 یک نمک سدیم است که از ترکیب آن با کربنیک اسید تولید میشود.
محتویات
۱کاربردها
۲سایر کاربردها
۳شکلگیری
۴تولید
۵فرایند Leblanc
۶فرایند سولوای (Solvay)
۷فرایند Hou
۸منابع
۹پانویس
1- کاربردها
مهمترین و اصلیترین کاربرد سدیم کربنات در تولید شیمیایی شیشه است. چنانچه سدیم کربنات را در دماهای بسیار بالا حرارت دهیم، و آن را با ماسه و کلسیم کربنات ترکیب کنیم و سپس به سرعت آن را سرد کنیم، محصول ما شیشه خواهد بود. سدیم کربنات همچنین به عنوان بک باز نسبتاً قوی در بسیاری از موارد به کار میرود. برای مثال، به عنوان تنظیم کننده PHH جهت حفظ پایداری شرایط قلیایی لازم برای عملکرد اکثر عوامل تولیدکننده از این ترکیب استفاده میشود. به عنوان یک افزودنی رایج در مخازن شهری جهت خنثی سازی اثر اسیدی کلر و افزایش PH به کار میرود. در آشپزی، گاهی اوقات به عنوان یک جایگزین برای سدیم هیدروکسید برای قلیایی کردن به خصوص در چوب شور (نان نمکی) به کار میرود. این خوراکها با یک محلول ماده قلیایی عمل آوری میشوند تا PH سطح ماده غذایی را تغییر کند که این سبب برشتگی بیشتر آن میشود. در شیمی این ماده به عنوان یک الکترولیت استفاده میشود و این از آن جهت است که الکتزولیتها معمولاً بازهای نمکی دارند و از طرفی سدیم کربنات به عنوان یک رسانای خوب در الکترولیز عمل میکند. همچنین به عنوان استاندارد اصلی تیتراسیون اسید و باز به کار میرود و این به دلیل پایداری جامد و گاز این ماده است که سبب سهولت در اندازهگیری دقیق تر جرم میشود. در خانهها به عنوان نرم کنندهٔ آب در شستوشوی لباسها به کار میرود. این ماده با یونهای منیزیم و کلسیم موجود در آب سخت مقابله میکند و مانع از تشکیل پیوند بین آنها با ماده شوینده به کار رفته میشود. بدون استفاده از سدیم کربنات شوینده اضافی برای خیساندن یونهای منیزیم و کلسیم نیاز میشود. سدیم کربنات در بخش شویندهای فروشگاهها به نام علف شوره (اشنان) دیده میشود و به طور مؤثری لکههای روغن، گریس، و الکل را از بین میبرد. سدیم کربنات همچنین به عنوان عامل ضد رسوبی از جمله رسوبهایی که در کتریها و ماشینهای بخار دیده میشود به کار میرود.
2- سایر کاربردها
در کارگاههای آجرپزی از سدیم کربنات به عنوان عامل خمیرکننده استفاده میشود تا حجم آب مورد نیاز جهت قالب گیری خاک رس کاهش یابد. همچنین از آن برای تهیه فوری ماکارونی استفاده میشود. سدیم کربنات یک افزودنی غذایی است (E500) که به عنوان تنظیم کننده میزان ترشی و نیز به عنوان پایدار کننده به کار میرود. سدیم کربنات همچنین در تولید بستنی چوبی کاربرد دارد. احساس خنکی و گازدار بودن نتیجهٔ واکنش گرماگیر بین سدیم کربنات و یک اسید ضعیف است (که معمولاً سیتریک اسید انتخاب میشود) و در نتیجهٔ آن کربن دی اکسید تولید میشود؛ یعنی زمانی که بستنی با بزاق دهان خیس میشود. سدیم کربنات همچنین برای از بین بردن کپک چوب یا سایر مواد به کار میرود.
3- شکلگیری
سدیم کربنات در آب محلول است. اما به طور طبیعی در بخشهای خشک، به خصوص در رسوبهای معدنی شکل گرفته از تبخیر آب دریاچهها یافت میشود. رسوبات معدنی نمکهای قلیایی طبیعی، ترکیبی از سدیم کربنات و سدیم بی کربناتاست که از کف دریاچههای خشک شده موجود در مصر از زمانهای گذشته استخراج میشده است تا در تهیه مومیایی و نیز ساخت ابتدایی شیشه استفاده شوند. سدیم کربنات به سه صورت ترکیب هیدراته شناخته شده است: سدیم کربنات ۲ آبه، سدیم کربنات ۷ آبه و سدیم کربنات تک آبه.
4- تولید
Trona یعنی سدیم بی کربنات کربنات ۲ آبه، در مناطق مختلفی از ایالات متحده استخراج میشود و تمام سدیم کربنات نیاز داخل را تأمین میکند. در ایران نیز مهمترین مکان تولید آن در شهرستان سرخه کارخانه جات کربنات سدیم سرخه میباشد که در جنوب غربی شهرسرخه در شهرستان سرخه، استان سمنان واقع شده است. رسوبات عظیم و طبیعی از آن در سال ۱۹۳۸ در نزدیکی Green River یافت شد و استخراج معادن در آمریکای شمالی بیشتر با توجه به جنبه اقتصادی و نه تولید صنعتی صورت گرفت. این ماده از دریاچههای قلیایی نیز به دست میآید، همچون دریاچهٔ Magadii در کنیا که البته با استفاده از فرایند لاروبی از روشهای ابتدایی به دست میآید و به طور طبیعی تجدید میشود و بنابراین هیچگاه این منبع طبیعی پایان نمیپذیرد.
بسیاری از گیاهان شورپسند که در آبهای شور زیست میکنند و در مقابل آب شور مقاومند میتوانند انواع ناخالص سدیم کربنات را به ما بدهند و این منابع شکل رایج و کنونی مورد استفاده در اروپا و سایر مناطق تا قرن ۱۹ بود. گیاهان خشکی زی مانند درخت آشنا و نیز علف شوره یا خزه و یا نوعی جلبک دریایی به نام کتانجک ابتدا جمعآوری شده و پس از خشک کردن سوزانده میشدند. خاکستر حاصل با آب شسته میشد تا محلول قلیایی تشکیل شود. این محلول پی از جوشانده شدن و خشک شدن محصول نهایی را به ما میدهد که Soda Ash نامیده میشود. این نام قدیمی برگرفته از منبع اولیه گیاهی آن است که یک بوته یک ساله به نام Salsola soda (barilla plant) است. غلظت سدیم کربنات موجود در Soda Ashh بازه گستردهای دارد، از ۳–۲٪ موجود در کتانجک تا ۳۰٪ موجود در بهترین “barilla” که از گیاهان علف شوره موجود در اسپانیا به دست میآید. منابع گیاهی و جلبک مورد استفاده برای Soda Ashh، و نیز برای پتاسهای قلیایی مرتبط، به طور افزایندهای تا پایان قرن ۱۸ ناکافی به نظر میرسیدند و جستجو برای یافتن راههای تجاری و پایدار برای ساخت و سنتز این ماده از نمکها و سایر مواد شیمیایی روز به روز گسترش مییافت.
5- فرایند Leblanc
در سال ۱۷۹۱، شیمیدان فرانسوی نیکلاس لبلنک روشی نوین را برای تولید سدیم کربنات از نمک، سولفوریک اسید، و ذغال سنگ به ثبت رساند. نخست نمک دریایی (سدیم کلرید) در سولفوریک اسید جوشانده میشد تا سدیم سولفور و گازهیدروژن کلرید تولید شود. همچنان که در واکنش زیر مشاهده میکنید. 2nacll+… سپس، مخلوط سدیم سولفات با سنگ آهک خرد شده (کلسیم کربنات) و ذغال حرارت داده میشد تا سدیم کربنات به همراه کربن دی اکسید و کلسیم سولفور حاصل شود.
سدیم کربنات از عصاره گیری خاکستر و آب به دست میآمد، و با تبخیر آب موجود، جمعآوری میشد. هیدروکلریک اسید حاصل از فرایند لبلنک، یکی از منابع اصلی آلودگی هوا است و کلسیم سولفید که به عنوان یک محصول جانبی تلقی میشود یک فراورده بیهوده میباشد. البته با این توصیفات، روش اصلی تولید سدیم کربنات تا اواخر دههٔ ۱۸۸۰ همین روش یادشده بود.[۳][۴]
6- فرایند سولوای (Solvay)
در سال ۱۸۶۱، یکی از شیمیدانان صنایع بلژیک، ارنست سولوای، روشی را معرفی کرد که سدیم کلرید با استفاده از آمونیاک به سدیم کربنات تبدیل میشود. این فرایند در یک برج بزرگ میان تهی صورت میگیرد و در انتهای این برج کلسیم کربنات (سنگ آهک) حرارت داده میشود تا کربن دی اکسید به دست آید:
و از قسمت بالای برج، محلول غلیظی از سدیم کلرید و آمونیک وارد آن میشود. به محض این که در میان آن کربن دی اکسید بجوشد، سدیم بی کربنات تهنشین میشود:
سپس سدیم بی کربنات با حرارت دادن در شکل سدیم کربنات ظاهر میشود و آب و کربن دی اکسید سایر فراوردهها را تشکیل میدهند. ضمناً، آمونیاک از فراورده جانبی آمونیوم کلرید مجدداً تولید میشود و این زمانی رخ میدهد که در مجاورت آهک (کلسیم هیدروکسید) باقیمانده از واکنش تولید کربن دی کسید قرار گیرد.
به این دلیل که فرایند سولوای آمونیاک مصرف شده را بازمیگرداند و تنها آب شور و آهک طی آن به مصرف میرسد و تنها فراوردهٔ اضافی آن کلسیم کلرید است، اساساً از نظر اقتصادی نسبت به فرایند لبلنک برتری دارد و به سرعت در تولیدات سدیم کربنات به عنوان روشی اصلی و کارامد مطرح شد. تا سال ۱۹۰۰، ۹۰٪ سدیم کربنات تحت این فرایند تولید شد و آخرین پایگاه تولید سدیم کربنات که با استفاده از روش قبلی یعنی روش لبلنک فعالیت میکرد، در آغاز دههٔ ۱۹۲۰۰ بسته شد.
7- فرایند Hou
توسط شیمیدان چینی به نام Hou Debang در دههٔ ۱۹۳۰ معرفی شد. این فرایند در مراحل اولیه مشابه فرایند سولوای است. اما به جای واکنش دادن محلول باقیمانده با آهک، کربن دی اکسید و آمونیاک یک محلول تشکیل میدهند و سدیم کلرید هنگامی که دما به حد ۴۰ درجه سانتیگراد رسید به محلول اضافه میشود. سپس محلول تا ۱۰۰ درجه سانتیگراد سرد میشود. آمونیوم کلرید تهنشین شده و با فیلترگذاری جدا میشود؛ و در ادامه محلول مجدداً برای تولید سدیم بی کربنات به کار گرفته میشود. این روش مشکل تولید کلسیم کلرید را حل کرده و از محصول جانبی آمونیوم کلریدnh4cll) نیز جهت کود دهی استفاده میشود. این روش، روش روز تولید سدیم کربنات در صنایع کنونی جهان
است.
| پابکم | ۱۰۳۴۰ |
| کماسپایدر | ۹۹۱۶ |
| UNII | 45P3261C7T |
| شمارهٔ ئیسی | 207-838-8 |
| ChEBI | CHEBI:29377 |
| ChEMBL | CHEMBL۱۸۶۳۱۴ |
| شمارهٔ آرتیئیسیاس | VZ4050000 |
| جیمول-تصاویر سه بعدی | Image 1 |
| خصوصیات | |
|---|---|
| فرمول مولکولی | Na2CO3 |
| جرم مولی | 105.9884 g/mol (anhydrous) 124.00 g/mol (monohydrate) 286.14 g/mol (decahydrate) |
| شکل ظاهری | White solid hygroscopic |
| بوی | Odorless |
| چگالی | 2.54 g/cm3 (anhydrous) 2.25 g/cm3 (monohydrate) 1.46 g/cm3 (decahydratee) |
| دمای ذوب | 851 °C (anhydrous)[۱] 100 °C (decomp monohydrate) 34 °C (decomp decahydrate) |
| دمای جوش |
1600 °C (anhydrous)
|
| انحلالپذیری در آب | 70 g/L (0 °C) 216 g/L (20 °C)[۱] 450 g/L (100 °C)[۲] |
| انحلالپذیری | نامحلول در اتانول و استون |
| خاصیت بازی (pKb) | 3.67 |
| ضریب شکست (nD) | 1.495 (anhydrous) 1.420 (monohydrate) |
| ساختار | |
|
موقعیت
هندسی |
trigonal planar |
| خطرات | |
| MSDS | MSDS |
| شاخص ئییو | ۰۱۱-۰۰۵-۰۰-۲ |
| طبقهبندی ئییو | Irritant (Xi) |
| کدهای ایمنی | R۳۶ |
| شمارههای نگهداری | S۲, S۲۲, S26 |
| لوزی آتش |
 |
| نقطه اشتعال | Non-flammable |
| ترکیبات مرتبط | |
| دیگر آنیونها | جوش شیرین |
| دیگر کاتیونها | لیتیوم کربنات پتاسیم کربنات کربنات روبیدیم کربنات سزیم |
| ترکیبات مرتبط | آمونیوم کربنات ناترون سدیم پرکربنات |
سولفوریک اسید: مشخصات
سولفوریک اسید که در گذشته با نام جوهر گوگرد خوانده میشد، اسیدی بسیار قوی است که با هر درصدی در آب حل میشود و فرمول شیمیایی آن H۲SO۴ است. پی اچ(pH) این اسید ۰/۵ (۵۵ دهم) میباشد.
سولفوریک اسید برای نخستین بار توسط جابر بن حیان کشف شد.[۱] او با تقطیر کانیهای سولفات آهن (معروف به زاج سبز) (آهن سولفات هفت آبه به فرمول FeSO4.7H2O) و مس(II) سولفات، این اسید را به دست آورد.
از سولفوریک اسید در مواد شوینده، رنگ نقاشی و غیره استفاده میشود.
محتویات
[نهفتن]
۱خواص فیزیکی
۲ساختار مولکولی و خصلت اسیدی
۳تولید سولفوریک اسید
۳.۱فرایند مجاورت[۳]
۳.۲دیگر روشها
۴منابع
۵پیوند به بیرون
1- خواص فیزیکی
این ماده دارای مولکولهای دارای گشتاور قطبی است که میتوانند با یکدیگر پیوند هیدروژنی برقرار کنند. پس سولفوریک اسید مایعی است با نقطه جوش بالا و هم چنین یک مایع ویسکوز (دارای گران روی زیاد) محسوب میشود. همین شرایط مولکولی باعث میشوند که سولفوریک اسید به خوبی در آب حل شود و محلولهای اسیدی مختلف تولید کند.
2- ساختار مولکولی و خصلت اسیدی
این ماده از مولکولهایی شامل یک اتم گوگرد، چهار اتم اکسیژن و دو اتم هیدروژن ساخته شده است. از آنجا که هیدروژنها به اتم اکسیژن متصل هستند، حامل بار مثبت جزیی میباشند و قادرند به عنوان هیدروژن اسیدی عمل کنند. با از دست دادن اولین هیدروژن، آنیون هیدروژنسولفات تولید میشود که با توجه به ساختارهای رزونانسی، بسیار پایدار است؛ بنابراین اولین تفکیک سولفوریک اسید، به شکل کامل انجام میشود:
H2SO4 + H2O → HSO4- + H3O+ (1
برای دومین مرحله، باید هیدروژن به شکل کاتیون، آنیون هیدروژنسولفات را ترک کند که چندان راحت نیست؛ بنابراین تفکیک دومین هیدروژن اسیدی در سولفوریک اسید، کامل نیست و یکواکنش تعادلی است:[۲]
HSO4- + H2O ⇔ H3O+ + SO42- (2
3- تولید سولفوریک اسید
3-1: فرایند مجاورت
سولفوریک اسید، یکی از مهمترین مواد شیمیایی صنعتی است که با استفاده از فرایند مجاورت تولید میشود. در مرحله نخست گوگرد در مجاورت اکسیژن ، اکسید شده و گوگرد دیاکسید به دست میآید:
S(s) + O2(g) → SO2(g) (1
در مرحله بعد گوگرد دی اکسید در مجاورت یک کاتالیزگر و در واکنش با اکسیژن اضافی به SO۳ اکسیده میشود:
SO2(g) + O2(g) → SO3(g) (2
این واکنش گرماده است و انتروپی(بی نظمی ) آن کاهش می یابد چون عامل انتروپی نامساعد است (پدیده های جهان به سمت بی نظمی بیشتر می روند) یک عامل نامساعد ترمودینامیکی دارد پس برگشت پذیر است
واکنش بالا در دمای معمولی بسیار کند است؛ لذا در روش صنعتی، از دماهای بالاتر (۴۰۰C تا۷۰۰C) و از یک کاتالیزور (مانند وانادیم پنتوکسید V۲O۵ یا اسفنج پلاتین) استفاده میشود. از واکنش گوگرد تری اکسید با آب، محلول سولفوریک اسید تشکیل میشود:
SO3(g) + H2O(l) → H2SO4(aq) (3
با تکرار مراحل بالا و دمیدن گوگرد تریاکسید درون محلول سولفوریک اسید، پیروسولفوریک اسید (H2S2O7) تشکیل میشود:
H2SO4(l) + SO3(g) → H2S2O7(l) (4
سپس با افزودن آب به پیروسولفوریک اسید، محلول سولفوریک اسید را تهیه میکنند:
H2S2O7(l) + H2O(l) → 2H2SO4(l) (۵
کنترل این روش که در آن، پیروسولفوریک اسید تشکیل میشود، آسان تر از واکنش مستقیم گوگرد تری اکسید با آب است؛ بنابراین از این واکنش برای تولید سولفوریک اسید با درصد معین و غلظت دلخواه استفاده میکنند.
3-2: دیگر روشها
سولفوریک اسید را میتوان در آزمایشگاه از واکنش گاز گوگرد دی اکسید با هیدروژن پراکسید (آب اکسیژنه) به دست آورد.
(g) + H۲O2 (l) → H۲SO۴ (l)SO2
روش دیگر تولید سولفوریک اسید در آزمایشگاه با استفاده از الکترولیز محلول مس (ll) میباشد که کاتد باید از فلزی باشد که رسانایی خوبی دارد، مانند مس وآند نیز باید از جنس پلاتین یا زغال باشد تا با محلول واکنش ندهد
| سولفوریک اسید | |||
|---|---|---|---|
|
|||
| شناساگرها | |||
| شماره ثبت سیایاس | ۷۶۶۴-۹۳-۹ | ||
| شمارهٔ آرتیئیسیاس | WS5600000 | ||
| خصوصیات | |||
| فرمول مولکولی | H2SO4 | ||
| جرم مولی | 98/078 g/mol | ||
| شکل ظاهری | مایع شفاف، بیرنگ و بیبو | ||
| چگالی | 1.84 g cm−3 liquid | ||
| دمای ذوب | 10°C | ||
| دمای جوش |
290°C bp of pure acid. 98% solution boils at 338 °C
|
||
| انحلالپذیری درآب | حلپذیری کامل (گرماده) انتالپی منفی | ||
| گرانروی | 26.7 cP at 20 °C | ||
| خطرات | |||
| طبقهبندی ئییو | |||
| کدهای ایمنی | R۳۵ | ||
| شمارههای نگهداری | (S1/2), S26, S۳۰, S45 | ||
| لوزی آتش |
 |
||
| نقطه اشتعال | غیر مشتعل | ||
| ترکیبات مرتبط | |||
| مرتبط با اسیدهای قوی | نیتریک اسید هیدروکلریک اسید هیدروبرمیک اسید پرکلریک اسید |
||
| ترکیبات مرتبط | سولفید هیدروژن اسید سولفورو پروکسیمونوسولفوریک اسید تری اکسید سولفور Oleum |
||
| به استثنای جایی که اشاره شدهاست در غیر این صورت، دادهها برای مواد به وضعیت استانداردشان داده شدهاند (در 25 °C (۷۷ °F)، ۱۰۰ kPa) | |||
| Infobox references | |||
سود پرک : مشخصات
سدیم هیدروکسید (به انگلیسی: Sodium hydroxide) یا کاستیک سودا (به انگلیسی: Caustic Soda) یا سود سوزآور با فرمول شیمیایی NaOH که مادهای جامد و سفیدرنگ با دمای ذوب ۱۳۹۰ درجه سانتیگراد و چگالی ۲٬۱۳۳ میباشد. این ماده، به آسانی میتواند رطوبت هوا را جذب نماید و به همین دلیل، باید هنگام حمل و نقل، تحت پوششهای حفاظتی لازم قرار گیرد. این ترکیب، در تماس با پوست، دارای اثر خورندگی است و برای جلوگیری از اثرات سوزانندگی آن، هنگام استفاده باید مورد توجه قرار گیرد.
آبپوشهای آن شناخته شدهاند و محلول قلیایی قوی در آب پدید میآورد، یعنی در آب بطور کامل به یونهای تشکیل دهندهاش (+Na و -OH) تفکیک میشود.
الکترولیز محلول سدیم کلرید
بیشترین مقدار هیدروکسید سدیم تولیدی، از طریق فرایند الکترولیز محلولهای سدیم کلرید در یکی از انواع ظروف الکترولیتی بدست میآید. بعنوان نمونه، در فرایند پیل جیوه (کاستنر-کلنر Castner-Kellner)، از جریانی از جیوه بعنوان کاتد استفاده میشود و ملغمه سدیم حاصل با آب ترکیب میشود و تولید سدیم هیدروکسید مینماید و در فرایند دیگر به نام پیل دیافراگم، الکترولیت از آند به کاتد حرکت میکند و دیافراگم (از جنس پنبه کوهی یا سایر مواد غشایی)، فراوردههای آند و کاتد را از هم جدا میسازد. در هر دو فرایند، علاوه بر سدیم هیدروکسید، گازکلر و نیز گاز هیدروژن تولید میشود.
فرایند سودا-آهک
یک فرایند قدیمیتر برای تولید سود سوزآور، عبارت از فرایند سودا - آهک میباشد که در آن سودا اَش (کلسیم هیدروکسید)، در واکنش با سدیم کربنات به کاستیک سودا تبدیل میشود.
Ca(OH)۲ + Na۲CO۳ → CaCO۳ + ۲ NaOH
کاربردها
سدیم هیدروکسید، بعنوان یک باز قوی، یکی از مواد شیمیایی صنعتی بسیار مهم بشمار میرود. برای نمونه، تولید سود در سال ۱۹۸۰ در آمریکا، ۱۲ میلیون تن بودهاست. در زمینههای مختلفی کاربرد دارد، از جمله در تولید مواد شیمیایی، ابریشم مصنوعی، خمیر کاغذ و کاغذ، در تولید رنگ، آلومینیوم، مواد پتروشیمی و پارچه، صابون و مواد شوینده بکار میرود.
همچنین در آزمایشگاهها برای تعیین غلظت اسیدهای مجهول درتیتراسیون اسید- باز از محلول قلیایی سدیم هیدروکسید استاندارد استفاده میشود. متأسفانه در صنایع غذایی از این ماده جهت تلخی زدایی از زیتون استفاده میشود که ممکن است اثرات نامطلوبی بر سلامت مصرفکنندگان بگذارد. سود سوزآور در دو نوع مایع و جامد در کارخانجات تولید میشود لذا سود مایع با خلوص ۵۰ درصد و ۳۳ درصد وجود داردو کیفیت بالایی داشته و برای صادرات معمولاً از سود مایع استفاده میشود البته سود مایع بخاطر قیمت نازلتر بیشتر مورد استقبال قرار میگیرد.
باید توجه داشت که؛ کاربردهای سود کاستیک پرک در صنعت بسیار وسیع است، صنایع مختلف با رویکردهای مختلف از این ماده استفاده مینمایند، برخی از این صنایع عبارتند از:
صنایع رنگرزی
تولید کارتن و کاغذ
صنایع چرم و نساجی
صنایع نفت و گاز و پترو شیمی
خنثی سازی اسید و باطری سازی
چربی گیرها و سایر صنایع وابسته
صنایع غذائی، صنایع شیر، کنسرو سازی
نوشابه سازی، کارخانه قند و شکر، کارخانه روغن
صنایع دارو سازی، الکل سازی و آرایشی و بهداشتی
صنایع فلزی و تولید شیشه روی، آلومینیوم، گالوانیزه و آبکاری
سود پرک کاربرد فراوانی در صنعت نفت و گاز دارد
سود پرک کاربرد فراوانی در صنایع نظامی دارد.
سود پرک برای صنایعی که با عوامل بیماری زا مواجه میشوند هم کاربرد دارد.
سود پرک در صنعت پلیمر و پت هم مصرف فراوانی دارد لذا بعنوان چربی بر استفاده می شود.
آزمایشهای آن
اگر سدیم هیدروکسید را کنار کلریدریک اسید قرار دهیم مادهای به نام سدیم کلرید بوجود میآید. در طی این واکنش گاز هیدروژن نیز آزاد میشود. علاوه بر این واکنش واکنشی نیز بین سدیم هیدروکسید و نیتریک اسید نیز وجود دارد که در طی این واکنش سدیم نیترات بوجود میآید. نحوه ساخت سدیم هیدروکسید نیز روش جالب و بسیار بسیار سادهای است. این واکنش این چنین است که سدیم را درون آب میریزیم در صورتی که مقدار سدیم زیاد باشد خطر آتشسوزی و انفجار نیز وجود دارد.
واکنش با فلزات
سدیم هیدروکسید در واکنش با فلز آلومینیوم گاز هیدروژن تولید میکند.
2Al + 2 NaOH + 6 H2O → 2 NaAl(OH)4 + 3 H2
خطرات سدیم هیدروکسید
- در صورت بلعیده شدن، سدیم هیدروکسید میتواند بسیار خطرناک باشد و سبب تحریک سیستم تنفسی شود. شدت خطرات زمانی قابل درک است که موجب سوختگی و تحریک این اعضا در صورت تماس با آن شود.
- اگر NaOH از طریق دهان بلعیده شود موجب ایجاد سوختگیهای متعددی در داخل دهان میشود. همچنین در صورت بلع کامل باعث همین تأثیرات در گلو و دیگر اعضاء نظیر معده میگردد.
- سدیم هیدروکسید میتواند با فلزات واکنش داده و تولید هیدروژن کند که سبب آتش گرفتن در صورت حضور اکسیژن میشود.
- با توجه به اثرات سمی آن، میتواند موجب خونریزی، استفراغ و اسهال شده و موجب افت فشار خون گردد.
- استنشاق هیدروکسید سدیم میتواند موجب تحریک دستگاه تنفسی شده و سبب مشکلاتی نظیر آماس ریوی شود.
- آبریزش بینی، تب، گلو درد و عطسه، برخی از مضرات تماس با این ماده شیمیایی هستند.
- زخم و اسکار بر روی پوست جزء خطرات رایج NaOH است. هیدروکسید سدیم بسیار خورنده است و میتواند سبب تخریب لایههای عمیق پوست شود.
- اگر چه ترکیبی آتش زا نیست ولی در صورت تماس با مواد قابل احتراق ممکن است آتش بگیرد. در هر صورت بهتر است از این مواد دور نگه داشته شود.
- نه تنها پوست بدن، بلکه سدیم هیدروکسید سبب ایجاد خوردگی کف پوشهای چوبی و سطوح رنگ شده نیز میشود.
- چشم در صورت تماس با NaOH ممکن است آسیب ببیند، و باعث موارد مختلفی نظیر گلوکوم، آب مروارید و کوری دائمی شود.
- هر نوع قرار گیری در معرض هیدروکسید سدیم، حتی مقادیر کم آن، میتواند سبب مشکلات حاد تنفسی گردد.
- نشت گاز از سدیم هیدروکساید در محلهای بسته، ممکن است موجب انسداد ریوی و بسته شدن راههای هوایی افراد شود.
| شناساگرها | |
|---|---|
| شماره ثبت سیایاس | ۱۳۱۰-۷۳-۲ |
| پابکم | ۱۴۷۹۸ |
| کماسپایدر | ۱۴۱۱۴ |
| UNII | 55X04QC32I |
| شمارهٔ ئیسی | 215-185-5 |
| شمارهٔ یواِن | 1823 |
| KEGG | D01169 |
| MeSH | Sodium+Hydroxide |
| ChEBI | CHEBI:32145 |
| شمارهٔ آرتیئیسیاس | WB4900000 |
| مرجع جیملین | 68430 |
| جیمول-تصاویر سه بعدی | Image 1 |
| خصوصیات | |
| فرمول مولکولی | NaOH |
| جرم مولی | 39.9971 g mol-1 |
| شکل ظاهری | White waxy opaque crystals |
| چگالی | 2.13 g cm−3 |
| دمای ذوب | ۳۱۸ درجه سلسیوس (۶۰۴ درجه فارنهایت; ۵۹۱ کلوین) |
| دمای جوش |
1388 °C, 1661 K, 2530 °F
|
| انحلالپذیری در آب | 1110 g dm-3 (at 20 °C) |
| انحلالپذیری درmethanol | 238 g dm-3 |
| انحلالپذیری درethanol | <-3 |
| فشار بخار | |
| اسیدی (pKa) | 13 |
| ضریب شکست (nD) | 1.412 |
| ترموشیمی | |
| آنتروپی مولار استاندارد S |
64.46 J K-1 mol-1 |
| آنتالپی استاندارد تشکیل ΔfH |
-425.93 kJ mol-1 |
| خطرات | |
| MSDS | External MSDS |
| GHS pictograms |  |
| شاخص ئییو | ۰۱۱-۰۰۲-۰۰-۶ |
| طبقهبندی ئییو | |
| کدهای ایمنی | R۳۵ |