نمایش موارد بر اساس برچسب: اسیدها
مشخصات اسیدهای پرمصرف و مواد خام
غلظت مواد خام (اسیدهای پر مصرف و ..)
|
آمونیوم هیدروکسید |
اسید سولفوریک | اسید نیتریک | اسید کلریدریک | ||
| 0.90 | 1.69 | 1.84 | 1.41 | 1.18 | وزن ویژه |
| 29.0% | 85.0% | 96.5% | 70.0% | 37.3% | درصد میانگین اسید یا باز موجود بر حسب غلظت |
| 535 | 1436 | 1772 | 989 | 442 | وزن اسید یا باز(برحسب گرم) بر لتیر محلول معرف(reagent) (میانگین) |
| 35.05 | 98.0 | 98.08 | 63.02 | 36.47 | وزن مولکولی |
| 15 | 44 | 36 | 16 | 12 | نرمالیته ی ماده معرف (reagent) تغلیظ شده |
| 66 | 23 | 28 | 64 | 83 |
حجم مورد نیاز(بر حسب ml) برای ساخت یک لیتر از محلول 1N
مرجع :سایت جلاپردازان پرشیا |
مشخصات اسید کلریدریک
اسید کلریدریک Choloridric acid:
نام تجاری : جوهر نمک
فرمول شیمیایی : HCl
نام های دیگر : هیدروژن كلراید , اسید كلروهیدریك , جوهر نمك ,کلریدریک اسید
اسید کلریدریک (جوهر نمک) یکی از فرآورده های صنایع شیمیایی است.
اسید کلریدریک ترکیبی از کلرید هیدروژن در آب است.
این ماده به شدت خورنده است .
اسید کلریدریک به عنوان محصول جانبی تولید تولوئن دی ایزوسیانات (TDI) مورد استفاده قرار میگیرد.?اسید کلریدریک جزو مواد معدنی و متعلق به گروه اسید ها می باشد
طرز تهیه این اسید شبیه طرز تهیه اسید نیتریک است. ?اسیدکلریدریک ترکیبی از کلرید هیدروژن در آب است.
ماده ای است شدیداً خورنده و اسید معدنی قوی است و به همین دلیل نیز کاربردهای زیادی در صنعت دارد. ?تولید مقادیر زیاد این اسید معمولاً وابسته به تولید سایر مواد صنعتی و شیمیایی است.
خصوصیات فیزیکی و شیمیایی :
حالت فیزیکی: مایع
شکل فیزیکی: مایع فرار
رنگ : بی رنگ یا زرد کمرنگ
بو : دارای بوی تند
حلالیت در آب : قابل حل است.
مشخصات :
اسید کلریدریک به دلیل اینکه جز مواد شیمیایی پایه است کاربرد بسیار وسیعی دارد.
گاز اسید کلریدریک بی رنگ با بوی تند و با طمع اسیدی است و از هوا سنگین تر است.
این ماده به آسانی تبدیل به مایع می شود و در حالت مرطوب یا محلول ، ماده آبی رنگ را به رنگ قرمز در می آورد.
این ماده با فلزات و هیدروکسید آنها ترکیب می شود.
تیزآب سلطانی یک ترکیب شامل اسید کلریدریک و اسید نیتریک می باشد که از انحلال نشادر در اسید نیتریک ساخته می شود.
مرجع کانال تلگرامی آموزش آبکار بهار 97
مشخصات اسید سولفوریک
نام: اسید سولفوریک
فرمول شیمیاییH2SO4
ظاهر: مایع شفاف ، بی رنگ و بی بو
وزن مولکولی۹۸ gr/mol
نقطه ذوب۱۰ درجه سانتیگراد
نقطه جوش۳۳۷ درجه سانتیگراد
دانسیته۱٫۸ gr/m3
سولفوریک اسید برای اولین بار توسط دانشمند ایرانی زکریای رازی در قرن نهم کشف گردید.آن این ماده را از طریق تقطیر خشک کانی هایی که شامل سولفات آهن (زاج سبز) و سولفات مس (کات کبود) بودند به دست آورد.بعد ها افراد دیگری مانند جان گلوبر ، جان روبک و جوزف گیلوساک روش های دیگری را برای تولید این ماده ارائه دادند.امروزه اسید سولفوریک در صنعت و تولید مواد شیمیایی مختلف کاربرد دارد بنابراین نیاز به روشی برای تولید بالا و مقرون به صرفه این ماده است.از واکنش SO3 با آب می توان اسید سولفوریک تولید کرد اما این روش به دلیل گرمازا بودن واکنش و وجود مشکلات در کنترل واکنش عملی نیست از این رو برای تولید این ماده از روش تماسی در مجاورت کاتالزور استفاده می شود.
در روش تماسی برای جلوگیری از مسموم شدن کاتالیزور مورد استفاده و قابلیت استفاده مجدد از آن که باعث کم شدن هزینه ها می شود ابتدا باید سولفیت و هوا را خالص کرد.از واکنش گوگرد با اکسیژن SO2 حاصل می شود:
S(s)+O2(g)—– >SO3(g)
در این مرحله در مجاورت کاتالیزور SO3 تشکیل می شود:
SO2(g)+O2(g)—– >2SO3(g)
این واکنش در دمای معمولی سرعت پایینی دارد به همین منظور واکنش را در محیطی با دمای ۴۰۰ تا ۷۰۰ درجه سانتیگراد انجام می دهند و برای واکنش از کاتالیزور وانادیم پنتوکسید (V2O5) استفاده می شود.
حال SO3 را به اسید سولفوریک غلیظ وارد می کنند که از این واکنش پیرو سولفوریک اسید بدست می آید:
H2SO4(l)+SO3(g)—– >H2S2O7(l)
اگر به پیرو سولفوریک اسید مقدار مشخصی آب اضاف گردد اسید با غلظت مورد نظر حاصل می شود:
H2S2O7(l)+H2O(l)—– >2H2SO4(l)
ویژگی های سولفوریک اسید:
سولفوریک اسید ، اسیدی معدنی و بسیار قوی است که به طور طبیعی در گازهای خارج شده از آتشفشان وجود دارد و با هر درصدی در آب حل می شود.واکنش آن با آب به شدت گرمازا است به همین دلیل باید از اضاف کردن یک باره ی آب به آن اجتناب کرد.اسید سولفوریک میل ترکیبی زیادی با آب دارد به طوری که در واکنش با سایر مواد هیدروژن و اکسیژن آن ها را با صورت آب جدا می کند.اسید سولفوریک خورنده است و قسمت عمده ای از باران اسیدی را تشکیل می دهد.قطرات آب به هنگام بارش با آلاینده های کارخانه ها و خودرو ها که در هوا معلق هستند واکنش می دهند و تولید اسید می کنند.اسید سولفوریک با فلزات واکنش می دهد و هر چه دما بالاتر رود میزان این واکنش بیشتر خواهد شد اما بر روی جیوه و سرب تاثیری ندارد.اسید سولفوریک در لیست مواد خطرناک قرار گرفته است.
اسید سولفوریک دارای ویژگا های مهمی است که باعث با اهمیت شدن آن گردیده است.برخی از این ویژگی ها عبارتند از:
عاملی خوب برای جذب آنهزینه پایین نگه داری و انتقال آنآمادگی برای تشکیل سولفات های آلیمطابقت با فرایند های اسیدی و خنثی سازیدارا بودن نقطه جوش بالا و در نتیجه امکار کار با آن در دماهای بالاکاربرد های سولفوریک اسید:
کاربرد در واکنش ها و فرایند های شیمیاییتولید کود های شیمیاییاستخراج فلزاتسنتز های شیمیاییتصفیه پساب هافرایند های نیتروژن دار کردنتولید مواد منفجره مانند TNT و نیتروگلیسیرینبه عنوان محلول الکترولیت در باطری های سربی وجود دارد.
واکنش پذیری
در شرایط سخت شیمیایی و در دما و فشار بالا منفجر می شود. با آب به شدت واکنش می دهد و یا روی آن منفجر می شود
عوارض جانبی
اسید سولفوریک با تمامی خواص و مزایای خود ماده ای خطرناک است و می تواند خسارات جبران ناپزیری را بر بدن وارد نماید.تماس آن با پوست منجر به سوزش و زخم شدن آن موضع می گردد و اگر وارد دهان شود آثار دائمی را بر جای خواهد گذاشت و همچنین باعث اسهال و استفراغ و درد شکمی و سوراخ شدن معده خواهد شد..تماس آن با چشم در اغلب موارد موجب کور شدن فرد می شود و در اثر تنفس آثاری مانند سرگیجه ، سردرد ، کاهش تنفس ، تحریک بینی و گلو و خشکی ریه مشاهده خواهد شد.در صورت تماس با بدن باید فورا با آب و صابون و محلول بی کربنات سدیم ۱ درصد شسته شود.
مرجع کانال تلگرامی آموزش آبکاری بهار 97
تذکرهای ایمنی کار با اسيدها
تذکرهای ایمنی کار با اسيدها
کار با اسيدها بسيار خطرناک است و فقط افراديکه از خطرات ناشي از کار با اسيدها كاملاً اگاهي دارند بايد با آنها کارکنند. مراقبتهاي زير را در آزمايشگاههايي که اسيدهاي قوي و ساير مايعات سوزان موجود است و براي افراد احتمال خطر هست بايد رعايت گردد.
1- وسايل مناسب وکافي براي شستشو موجود باشد تا چناچه اگر بدن يا لباس افراد به اينگونه مايعات آلوده شد فوراً شستشو داده شود.
2- مقدار کافي داروي شستشو چشم بايد هميشه در محل مناسب و با برچسب مشخص موجود باشد.
3- بايد لباسهاي عايق اسيد، عينک ، کلاه عايق اسيد ، پوتين ، دستکش لاستيکي فراهم باشد
.4- ظروف محتوي اسيدها بخصوص اسيد سولفوريک نبايستي در معرض تابش نور آفتاب قرار گيرد. آنها را در شيشه هاي کدر و دور ازآفتاب قرار دهيد.
5- هنگام نقل و انتقال ظروف اسيد قبل از حمل اينگونه ظروف بايستي سرپوش ظرف را کمي شل کرد و پس از تخليه فشار آن درب آنرا محکم بست.
6.کار با اسیدها و بازها باید زیر هود انجام گیرد.
7.در آزمایشگاه باید اسیدها، بازها، مواد آتیش گیر و مواد سمی جدا از یک دیگر و دیگر مواد، در جای مخصوصی نگه داری شوند.
8.اسیدها باید دور از فلزهای فعال هم چون سدیم، پتاسیم و ... نگه داری شوند تا از آتش سوزی و انفجار جلوگیری شود. همچنین اسیدها باید جدا از بعضی مواد شیمیایی که در اثر مجاورت با آن ها گازهای سمی و کشنده آزاد می شود (مانند سدیم سیانید و سولفید آهن) نگه داری شوند.
9.اسیدهای قوی همچون نیتریک اسید و پر کلریک اسید باید جدا از اسیدهای آلی و مواد آتش گیر نگه داری شوند.
10.هنگام کار با اسید ها از عینک ،دستکش و لباس مخصوص استفاده کنید.
11.مواد شيميايي خطرناك را در ظروف غذا(مثل ليوان،بطري و شيشه ها) نريزيد چون ممكن است با مواد خوراكي و آشاميدني اشتباه گرفته شود.
12.در هنگام استفاده از محلول آمونياك، در محيط باز يا اتاق داراي پنجرهي باز و تهويه كار كنيد.
13.بچه ها بايد حدودا ۳ متر دورتر و در خلاف جريان هوا بايستند و همواره بايد يك فرد متخصص در جريان اينگونه آزمايش ها حضور داشته باشد.
رقیق کردن اسیدها: در رقیق کردن اسیدها برای کارهای روزانه توجه به نکات زیر اهمیت دارد.
1– ظروف فلزي را نبايد براي رقيق کردن مورد استفاده قرار داد.
2- در عمل بايستي هميشه اسيد را در آب ريخته ، نه آب را در اسيد زيرا اگر آب روي اسيد ريخته شود توليد حرارت نموده که با ايجاد حباب هاي هوا ذرات اسيد را شديداً به اطراف پخش مي کند. ونوعی حالت انفجار گونه پدید می آورد که حتی باعث ترکیدن بطری و ظروف آزمایشگاهی می شود.
3- پس از رقيق کردن بايد مدتي بگذرد تا اسيد بتدريج سرد شود سپس از آن استفاده نمود.
4- در موقع اضافه نمودن اسيد غليظ به آب سعي شود اسيد را با پيپت برداشت و در موقع تخليه در آب به جداره داخلي ظرف خالي کرد و سپس با به هم زدن شيشه اي آنرا مخلوط کرد.
5-هیچگاه از مکش به وسیله دهان استفاده نکنید حتی به میزان بسیار کم هم خطرناک است.
مرجع کانال تلگرامی آموزش آبکاری بهار 97
اسید های آبکاری، کاربرد ها، خطرات- اسید کلریدریک
مقدمه
اسید کلریدریک یک اسید معدنی قوی خورنده با کاربرد صنعتی زیاد است. یک محلول بدون رنگ و بسیار سوزاننده از کلرید هیدروژن (HCl) در آب است، هنگامی که با یک پایه ارگانیک واکنش می دهد، یک نمک هیدروکلراید را تشکیل می دهد.اسید هیدروکلریک توسط کیمیاگر جابر بن حیان در حدود سال 800 میلادی کشف شد. نام های قدیمی اسید هیدروکلریک ، acidum salis ، مورتیک اسید و جوهر نمک نامیده می شود، زیرا از سنگ نمک و زاج سبز (سولفات آهن (II)) (توسط Basilius Valentinus در قرن 15 میلادی) و بعدها توسط نمک شیمیایی معمولی و اسید سولفوریک (توسط یوهان رودلف گلاوبر در قرن هفدهم) تولید شد.هیدروکلریک اسید آزاد به طور رسمی در قرن شانزدهم توسط لیبیویوس شناسانده شد.بعدها، توسط شیمیستهایی مانند گلابر، پریستلی و دیوی در تحقیقات علمی مورد استفاده قرار گرفت. اسید کلریدریک غیر از حالت تحت فشار و سرد شدن، اگر کمتر از حدود 60% آب در آن وجود داشته باشد تبدیل به گاز خواهد شد. اسید کلریدریک همچنین...............................
برای خواندن ادامه مطلب به سایت نویسنده مقاله مراجعه فرمایی.
مرجع: شرکت جلاپردازان پرشیا
اسید های آبکاری، کاربرد ها، خطرات، حفاظت سلامتی
اسید های آبکاری، کاربرد ها، خطرات، حفاظت سلامتی
مقدمه
اسید هیدروفلوئوریک محلولی از هیدروژن فلوراید(HF) در آب است. که آن پیشگام بیشتر ترکیبهای فلوئور دار شامل، داروهایی مثل فلوئوکستین (Prozac) ،مواد گوناگونی مثل PTFE(تفلون)، و خود فلوئور عنصری، است. یک محلول بی رنگ بسیار خورنده است، و توانایی حل بسیاری از مواد بخصوص اکسیدها را دارد. توانایی آن برای حل کردن شیشه از قرن 17 میلادی، حتی قبل از اینکه کارل ویلهلم اسکیل که آن را در مقادیر زیاد در سال 1771 آماده کرد، شناخته شده است.اسید هیدروفلوئوریک معمولا به دلیل واکنش پذیری بالا نسبت به شیشه و واکنش پذیری متوسط نسبت به بسیاری از فلزات، در ظروف پلاستیکی ذخیره می شود (اگر چه کمی به PTFE نفوذ پذیری دارد).......................................
برای خواندن ادامه مطلب به سایت نویسنده مقاله مراجعه فرمایید.
مرجع جلاپردازان پرشیا
اسید های آبکاری، کاربرد ها، خطرات اسید هیدروفلوئوریک
اسید های آبکاری، کاربرد ها، خطرات، حفاظت سلامتی
Acids for plating, applications, Safety and Hazards
بخش چهارم:
سید های آبکاری، کاربرد ها، خطرات، حفاظت سلامتی
Acids for plating, applications, Safety and Hazards
بخش چهارم:
Chapter Four
اسید هیدروفلوئوریک
| لیست اسید های مورد بررسی | Acids list for review |
|
اسید سولفوریک اسید کلریدریک اسید نیتریک اسید هیدروفلوئوریک اسید فسفریک اسید کرمیک اسید اگزالیک |
Sulfuric acid Hydrochloric acid Nitric acid Hydrofluoric acid Acid phosphoric Chromic acid Oxalic acid |
|
properties |
|
| HF | Chemical formula |
| 20.01 g/mol | Molar mass |
| Colorless solution | Appearance |
| 1.15 g/mL (for 48% soln.) | Density |
| −83.6 °C (−118.5 °F; 189.6 K) | Melting point |
| 19.5 °C (67.1 °F; 292.6 K) | Boiling point |
| Miscible. | Solubility in water |
| 3.17 | Acidity (pKa) |
|
مقدمه اسید هیدروفلوئوریک محلولی از هیدروژن فلوراید(HF) در آب است. که آن پیشگام بیشتر ترکیبهای فلوئور دار شامل، داروهایی مثل فلوئوکستین (Prozac) ،مواد گوناگونی مثل PTFE(تفلون)، و خود فلوئور عنصری، است. یک محلول بی رنگ بسیار خورنده است، و توانایی حل بسیاری از مواد بخصوص اکسیدها را دارد. توانایی آن برای حل کردن شیشه از قرن 17 میلادی، حتی قبل از اینکه کارل ویلهلم اسکیل که آن را در مقادیر زیاد در سال 1771 آماده کرد، شناخته شده است.اسید هیدروفلوئوریک معمولا به دلیل واکنش پذیری بالا نسبت به شیشه و واکنش پذیری متوسط نسبت به بسیاری از فلزات، در ظروف پلاستیکی ذخیره می شود (اگر چه کمی به PTFE نفوذ پذیری دارد). |
Introduction Hydrofluoric acid is a solution of hydrogen fluoride (HF) in water. It is a precursor to almost all fluorine compounds, including pharmaceuticals such as fluoxetine (Prozac), diverse materials such as PTFE (Teflon), and elemental fluorine itself. It is a colourless solution that is highly corrosive, capable of dissolving many materials, especially oxides. Its ability to dissolve glass has been known since the 17th century, even before Carl Wilhelm Scheele prepared it in large quantities in 1771. Because of its high reactivity toward glass and moderate reactivity toward many metals, hydrofluoric acid is usually stored in plastic containers (although PTFE is slightly permeable to it). |
|
اسیدیته اسید فلورئوریک به دلیل تعادلی تجزیه شدن آن در آب به عنوان اسید ضعیف دسته بندی میشود.آن در محلول های آبی مشابه طرز اسید های رایج دیگر یونیزه میشود: HF + H2O ⇌ H3O+ + F− HF تنها اسید هیدروهالیدی است که به عنوان اسید قوی در نظر گرفته نمیشود. زمانی که غلظت HF به 100% نزدیک میشود مقدار اسیدیته آن به طرز چشم گیری افزایش میابد زیرا موجب homoassociationمیشود: 3 HF ⇌ H2F+ + FHF− آنیون بیفلوئورید (FHF-) با پیوند بسیار قوی هیدروژن-فلورین- هیدروژن پایدار شده است. |
Acidity Hydrofluoric acid is classified as a weak acid because of its lower dissociation constant compared to the strong acids. It ionizes in aqueous solutions in a similar fashion to other common acids: HF + H2O ⇌ H3O+ + F− HF is the only hydrohalic acid that is not considered a strong acid, i.e. it does not fully ionize in dilute aqueous solutions. When the concentration of HF approaches 100%, the acidity increases dramatically because of homoassociation: 3 HF ⇌ H2F+ + FHF− The bifluoride (FHF−) anion is stabilized by the very strong hydrogen–fluorine-hydrogen bond. |
|
روش ساخت اسیدفلوئوریک بوسیله اعمال حرارت از فلورین معدنی (CaF2) با اسید سولفوریک غلیظ تولید میشود. زمانی که این دو در دمای 250 درجه سانتی گراد باهم ترکیب میشوند و واکنش میدهند طبق واکنش زیر هیدروژن فلوراید و کلسیم سولفات تولید میکنند: CaF2 + H2SO4 → 2 HF + CaSO4 اگر چه سنگ معدن فلوئوریت یک پیش ماده مناسب و یک منبع عمده تولید جهانی HF است، HF همچنین به عنوان یک محصول جانبی در تولید اسید فسفریک تولید می شود، که از آپاتیت معدنی استخراج میشود. منابع آپاتیت عموما شامل درصد کمی از فلوئوروآپاتیت میباشد، تجزیه اسید که یک جریان گازهای حاوی دی اکسید گوگرد،آب، HF، مثل ذرات غبار آزاد می کند. بعد از جداسازی جامدات، گازها با اسید سولفوریک و الیوم(به مقاله اسید سولفوریک مراجعه کنید- اسید سولفوریک دودزا) مورد تعامل قرار میگیرند و HF بی آب حاصل میشود. با توجه به ماهیت خورنده HF، تولید آن با انحلال مواد معدنی سیلیکات همراه است و به همین ترتیب مقدار قابل توجهی از اسید فلوروسایلیکیک تولید می شود. |
Methods of Manufacturing Hydrofluoric acid is produced by treatment of the mineral fluorite (CaF2) with concentrated sulfuric acid. When combined at 265 °C, these two substances react to produce hydrogen fluoride and calcium sulfate according to the following chemical equation: CaF2 + H2SO4 → 2 HF + CaSO4 Although bulk fluorite is a suitable precursor and a major source of world HF production, HF is also produced as a by-product of the production of phosphoric acid, which is derived from the mineral apatite. Apatite sources typically contain a few percent of fluoroapatite, acid digestion of which releases a gaseous stream consisting of sulfur dioxide (from the H2SO4), water, and HF, as well as particulates. After separation from the solids, the gases are treated with sulfuric acid and oleum to afford anhydrous HF. Owing to the corrosive nature of HF, its production is accompanied by the dissolution of silicate minerals, and, in this way, significant amounts of fluorosilicic acid are generated. |
|
امنیت و سلامتی اسید فلوئوریدریک علاوه بر این که یک مایع خورنده است، همچنین در هنگام تماس یک سم بسیار قوی است. به علت توانایی اسید فلوئوریدریک در نفوذ بافتی، مسمومیت میتواند به راحتی از طریق تماس با پوست یا چشم، یا زمانی که استنشاق یا بلعیده شود اتفاق افتد. نشانه های قرار گرفتن در معرض اسید هیدروفلوئوریک ممکن است بلافاصله آشکار نشود، و این می تواند قربانیان را به اشتباه اندازد و باعث شود تا درمان پزشکی به تاخیر بیفتد.HF باعث تداخل عملکرد سیستم عصبی میشود، به این معنی که ممکن است سوختگی در ابتدا با درد همراه نباشد.قرار گرفتن در معرض تصادفی می تواند بدون توجه به علائم، باعث تعویق در درمان شود و میزان و شدت آسیب را افزایش دهد.علائم سوختگی با HF شامل التهاب چشم، پوست، بینی و گلو، سوختگی چشم و پوست، رینیت، برونشیت، ادما ریوی (ایجاد مایع در ریه ها) و آسیب استخوان است. |
Health and safety In addition to being a highly corrosive liquid, hydrofluoric acid is also a powerful contact poison. Because of the ability of hydrofluoric acid to penetrate tissue, poisoning can occur readily through exposure of skin or eyes, or when inhaled or swallowed. Symptoms of exposure to hydrofluoric acid may not be immediately evident, and this can provide false reassurance to victims, causing them to delay medical treatment. HF interferes with nerve function, meaning that burns may not initially be painful. Accidental exposures can go unnoticed, delaying treatment and increasing the extent and seriousness of the injury. Symptoms of HF exposure include irritation of the eyes, skin, nose, and throat, eye and skin burns, rhinitis, bronchitis, pulmonary edema (fluid buildup in the lungs), and bone damage. |
|
علائم سوختگی با اسید فلورئوریک مولکول هیدروژن فلورئورید بسیار متحرک است که ممکن است به آسانی از پوست حرکت کند. از آنجا که فلوئور تمایل زیادی به ترکیب با کلسیم دارد، استخوان ها مورد حمله قرار می گیرند و این ممکن است منجر به هیپوكالسیمی (کاهش کلسیم موجود در خون) شود.ممکن است درد بلافاصله بعد از سوختگی وجود نداشته باشد، و منجر به زخمی شدن فردی شود که بر این باور است که در خطر نیست. علائم در معرض قرار گرفتن ü غلظت کمتر از 20٪ - erythema (قرمزی پوست) و درد ممکن است تا 24 ساعت بروز نکند، و اغلب سوختگی گزارش نمیشود تا زمانی بافت آسیب شدیدی میبیند. در یک مطالعه مشخص شد علائم٪7HF 1 تا چند ساعت، 12٪ HF در کمتر از یک ساعت و 5/14٪ HFبلافاصله ایجاد میشود. ü غلظت های 20-50%- erythema و درد ممکن است 1-8 ساعت بعد ایجاد شود، و اغلب تا انجا که بافت آسیب شدید نبیند گزارش نمیشود. ü غلظت های بیشتر از 50%- ایجاد سوختگی بلافاصله میکند،erythema، و آسیب بافتی. |
Symptoms of Hydrofluoric Acid Burns v The Hydrogen Fluoride molecule is so mobile that it may easily pass through the skin.Because Fluorine has an extremely high affinity for Calcium, bones will be attacked,and this may result in hypocalcaemia. There may be no pain immediately after the burn,leading the injured person to believe that they are not in danger. Symptoms of Exposure
|
اسید های آبکاری، کاربرد ها، خطرات، حفاظت سلامتی
اسید های آبکاری، کاربرد ها، خطرات، حفاظت سلامتی
Acids for plating, applications, Safety and Hazards
| لیست اسید های مورد بررسی | Acids list for review |
|
اسید سولفوریک اسید کلریدریک اسید نیتریک اسید فلوریدریک اسید فسفریک اسید کرمیک اسید اگزالیک |
Sulfuric acid Hydrochloric acid Nitric acid Hydrofluoric acid Acid phosphoric Chromic acid Oxalic acid |
بخش اول:
Chapter one
اسید سولفوریک :
| 7664-93-9 | CAS No |
| Sulfuric acid | Chemical Name |
| H2SO4 | Structural Formula |
| 98 | Molecular weight |
| Dihydrogen sulphate | Other names |
| Properties (ویژگی ها) | |
| H2SO4 | Chemical formula |
| 98.079 g/mol | Molar mass |
| Clear, colorless liquid | Appearance |
| odorless | Odor |
| 1.84 g/cm3, liquid | Density |
| 10 °C (50 °F; 283 K) | Melting point |
| 337 °C (639 °F; 610 K) When sulfuric acid is above 300 °C (572 °F), it will decompose slowly | Boiling point |
| miscible, exothermic | Solubility in water |
| 0.001 mmHg (20 °C) | Vapor pressure |
| −3, 1.99 | Acidity (pKa) |
| 26.7 cP (20 °C) | Viscosity |
| 157 J•mol−1•K−1 | Std molar |
| −814 kJ•mol−1 | entropy (So298) |
| Danger | formation (ΔfHo298) |
| H314 | GHS pictograms |
| Non-flammable | GHS signal word |
|
مقدمه اسید سولفوریک (به بیان دیگر سولفوریک اسید) یک اسید معدنی با فرمول مولکولی H2SO4، یک مایع بی رنگ، بی بو و محلول در آب است. میتوان خورندگی آن را به طور عمده به طبیعت اسید قوی بودن آن نسبت داد. همچنین جاذب رطوبت است، به راحتی بخار آب را از هوا جذب می کند. اسید سولفوریک حتی در حد غلظت متوسط هنگام تماس با پوست بسیار خطرناک است. اسید سولفوریک دارای طیف گسترده ای از کاربردهای از جمله در پاک کننده های خانگی اسیدی، به عنوان یک الکترولیت در باتری های اسید سرب و در مواد تمیز کننده مختلف است و همچنین یک ماده اصلی در صنعت شیمیایی است. استفاده های اصلی شامل پردازش مواد معدنی، تولید کود، پالایش نفت، فرآیند فاضلاب و سنتز مواد شیمیایی است. |
Introduction Sulfuric acid (alternative spelling sulphuric acid) is a mineral acid with the molecular formula H2SO4. It is a colorless odorless syrupy liquid that is soluble in water. Its corrosiveness can be mainly ascribed to its strong acidic nature. It is also hygroscopic, readily absorbing water vapour from the air. Sulfuric acid at even moderate concentrations is very dangerous upon contact with skin. Sulfuric acid has a wide range of applications including in domestic acidic drain cleaners, as an electrolyte in lead-acid batteries and in various cleaning agents. It is also a central substance in the chemical industry. Principal uses include mineral processing, fertilizer manufacturing, oil refining, wastewater processing, and chemical synthesis.. |
|
درجات اسید سولفوریک اگر چه تقریبا اسید سولفوریک 99٪ را می توان تولید کرد، اما به دلیل خروج SO3 در نقطه جوش نهایت غلظت تولیدی 3/98 درصد اسید است. خلوص 98٪ در ذخیره سازی پایدار تر است و فرم معمولی آن چیزی است که به عنوان "اسید سولفوریک غلیظ" توصیف می شود. غلظت های دیگر برای مقاصد مختلف استفاده می شود. برخی از غلظت های رایج از جمله: |
Grades of sulfuric acid Although nearly 99% sulfuric acid can be made, the subsequent loss of SO3 at the boiling point brings the concentration to 98.3% acid. The 98% grade is more stable in storage, and is the usual form of what is described as "concentrated sulfuric acid". Other concentrations are used for different purposes. Some common concentrations are: |
| Common name | Concentration | Density | Mass fraction |
| dilute sulfuric acid | (mol/L) | (kg/L) | H2SO4 |
| battery acid | ≈1 | 1.07 | 10% |
| (used in lead–acid batteries) | 4.2–5 | 1.25–1.28 | 29–32% |
| chamber acid | 9.6–11.5 | 1.52–1.60 | 62–70% |
| fertilizer acid | 13.5–14 | 1.70–1.73 | 78–80% |
|
روش ساخت اسید سولفوریک از گوگرد، اکسیژن و آب از طریق فرایند تماس معمولی (DCDA) یا فرایند اسید سولفوریک مرطوب (WSA) تولید می شود. |
Manufacture Sulfuric acid is produced from sulfur, oxygen and water via the conventional contact process (DCDA) or the wet sulfuric acid process (WSA(. |
||||||||||||||||||||||||
در مرحله اول، گوگرد برای تولید دی اکسید گوگرد سوزانده می شود. S (s) + O2(g) → SO2(g) سپس آن را با استفاده از اکسیژن، در حضور کاتالیزور اکسید وانادیوم (V) اکسید کرده و به سولفور تری اکسید تبدیل می کند. این واکنش تشکیل تری اکسید سولفور برگشت پذیر و حرارت زا است. (2 SO2(g)+O2 (g) ⇌ 2SO3(g (درحضور V2O5) تری اکسید گوگرد از الیوم (H2S2O7)، که به عنوان اسید سولفوریک فومینگ شناخته می شود، به H2SO4 97-98٪ جذب می شود. الیوم سپس با آب رقیق می شود تا اسید سولفوریک متبلور تولید کند. H2SO4(l)+SO3 (g)à H2S2O7(l) H2S2O7(l)+H2O(l)à2H2So4(l) با توجه به ماهیت بسیار گرمازا، واکنش بین تری اکسید گوگرد و آب، حل شدن مستقیم SO3 در آب امکان پذیر نیست. SO3(g)+H2O(l)àH2SO4 |
In the first step, sulfur is burned to produce sulfur dioxide. S (s) + O2(g) → SO2(g) This is then oxidized to sulfur trioxide using oxygen in the presence of a vanadium(V) oxide catalyst. This reaction is reversible and the formation of the sulfur trioxide is exothermic. 2SO2(g)+O2 (g) ⇌ 2SO3(g)(in presence of V2O5) The sulfur trioxide is absorbed into 97–98% H2SO4 to form oleum (H2S2O7), also known as fuming sulfuric acid. The oleum is then diluted with water to form concentrated sulfuric acid. H2SO4(l)+SO3 (g)à H2S2O7(l( H2S2O7(l)+H2O(l)à2H2So4(l( Note that directly dissolving SO3 in water is not practical due to the highly exothermic nature of the reaction between sulfur trioxide and water. SO3(g)+H2O(l)àH2SO4 |
||||||||||||||||||||||||
در قدم اول، گوگرد برای تولید دی اکسید گوگرد سوزانده می شود: S(s) + O2(g) → SO2(g) یا، به جای آن، گاز سولفید هیدروژن (H2S) به گاز SO2 سوزانده می شود: (2H2S+3O2à2H2O+2SO (-518 kj/mol سپس با استفاده از اکسیژن و اکسید وانادیوم (V) به عنوان کاتالیزور به سولفور تری اکسید، اکسید می شود. SO+2O2à2SO3 (-99 kj/mol)2 (واکنش قابل برگشت است) تری اکسید گوگرد به اسید سولفوریک H2SO4 هیدرات(آب میگیرد) می شود. (SO2+3H2OàH2SO4 (g) (-101 kj/mol2 آخرین مرحله چگالی سولفوریک اسید را به مایع 98-97% رساندن است: H2SO4 (g)à H2SO4 (l) (-69 kj/mol) |
Wet sulfuric acid process In the first step, sulfur is burned to produce sulfur dioxide: S(s) + O2(g) → SO2(g) or, alternatively, hydrogen sulfide (H2S) gas is incinerated to SO2 gas: 2H2S+3O2à2H2O+2SO (-518 kj/mol) This is then oxidized to sulfur trioxide using oxygen with vanadium(V) oxide as catalyst 2SO+2O2à2SO3 (-99 kj/mol) (reaction is reversible) The sulfur trioxide is hydrated into sulfuric acid H2SO4: 2SO2+3H2OH2SO4 (g) (-101 kj/mol) The last step is the condensation of the sulfuric acid to liquid 97–98% H2SO4: H2SO4 (g)à H2SO4 (l) (-69 kj/mol) |
||||||||||||||||||||||||
دیگر روش که ماکمتر به خوبی میشناسیم روش متابی سولفید است، که در آن متابی سولفیت در انتهای یک بشر قرار داده می شود و 6/12 مولار اسید هیدروکلریک غلیظ اضافه می شود. گاز حاصل از جوشاندن اسید نیتریک که بخارات خرمایی را آزاد می کند. اتمام واکنش با توقف تولید گازها مشخص میشود. در این روش ایجاد بخار جدایی ناپذیر است که بسیار راحت است. SO2 + HNO3 + H2O→ H2SO4 + NO اسید سولفوریک را می توان در آزمایشگاه بوسیله سوختن گوگرد در هوا و حل کردن گاز تولید شده در محلول هیدروژن پراکسید تولید کرد. SO2 + H2O2 → H2SO4 تا قبل از 1900، بیشتر اسید سولفوریک برای فرآیند محفظه سربی تولید میشد. در اواخر سال 1940، اسید سولفوریک تا 50 درصد در ایالات متحده توسط فرآیند دستگاه محفظه تولید میشد. |
Another method is the less well-known metabisulfite method, in which metabisulfite is placed at the bottom of a beaker, and 12.6 molar concentration hydrochloric acid is added. The resulting gas is bubbled through nitric acid, which will release brown/red vapors. The completion of the reaction is indicated by the ceasing of the fumes. This method does not produce an inseparable mist, which is quite convenient. SO2 + HNO3 + H2O→ H2SO4 + NO Sulfuric acid can be produced in the laboratory by burning sulfur in air and dissolving the gas produced in a hydrogen peroxide solution. SO2 + H2O2 → H2SO4 Prior to 1900, most sulfuric acid was manufactured by the lead chamber process. As late as 1940, up to 50% of sulfuric acid manufactured in the United States was produced by chamber process plants. |
||||||||||||||||||||||||
|
امنیت و خطرات کد اظهارنامه خطر: سیستم جهانی طبقه بندی و برچسب گذاری مواد شیمیایی (GHS) که توسط کمیسیون اقتصادی سازمان ملل متحد برای اروپا (UNECE)ایجاد شده، یک سیستم هماهنگ بین المللی برای رسیدگی به حمل و نقل، استفاده و دفع مواد شیمیایی در حین محافظت از سلامت انسان و محیط است. GHS در سراسر جهان از جمله توسط سازمان های دولتی ایالات متحده اجرا می شود. اطلاعات در این بخش عناصر اساسی برچسب GHS را دربر می گیرد و همه چیز را شامل نمی شود. طبقه بندی GHS
اطلاعات ممکن است بین اعلان ها بسته به ناخالصی ها، افزودنی ها و عوامل دیگر متفاوت باشد. |
Safety and Hazards hazard statement code: The Globally Harmonized System of Classification and Labelling of Chemicals (GHS) developed by the United Nations Economic Commission for Europe (UNECE) is an internationally-harmonized system to address the handling, transport, use, and disposal of chemicals while protecting human health and the environment. GHS is being implemented globally including by U.S. government agencies. The information in this section addresses basic label elements of GHS and is not all-inclusive. GHS Classification
Information may vary between notifications depending on impurities, additives, and other factors. |
||||||||||||||||||||||||
|
سازمان حفاظت محیط زیست ایمنی شیمیایی اسید سولفوریک مایع - مثلث زرد - این ماده شیمیایی، شاخصهای مورد نیاز برای انتخاب ایمن را برای طبقه بندی مواد تشکیل دهنده آن برآورد کرده است، اما دارای برخی مسائل مربوط به جزییات ویژگی های ذاتی ماده است. بویژه، یک ماده شیمیایی با این کد دارای خطرات زیادی برای سلامت انسان و محیط زیست همراه است. در حالی که این طبقه بندی جزو بهترین دسته بندی برای مواد شیمیایی است ولی برای هر ماده باید شرایط خاص استفاده آن در نظر گرفته شود . |
EPA Safer Chemical Sulfuric acid (aqueous) - Yellow triangle - The chemical has met Safer Choice Criteria for its functional ingredient-class, but has some hazard profile issues. Specifically, a chemical with this code is not associated with a low level of hazard concern for all human health and environmental endpoints. While it is a best-in-class chemical and among the safest available for a particular function, the function fulfilled by the chemical should be considered an area for safer chemistry innovation. |
||||||||||||||||||||||||
|
خطرات سلامتی باعث خوردگی تمام بافت های بدن میشود. استنشاق بخار آن می تواند باعث آسیب جدی ریه شود. تماس با چشم ممکن است منجر به از دست دادن بینایی کامل شود. تماس پوستی ممکن است باعث ایجاد necrosis شدید شود. مقدار مرگبار برای بزرگسالان: بین 1 قاشق چای خوری و نیم اونس از ماده شیمیایی غلیظ است. حتی اگر چندین قطره به نای دسترسی پیدا کند ممکن است کشنده باشد. قرار گرفتن در معرض مداوم ممکن است سبب برونشیت نای، استوماتیت، ملتحمه و گاستریت شود. سوارخ کردن معده و التهاب ممکن است رخ دهد و ممکن است درادامه فروپاشی گردش خون را به همراه داشته باشد. شوک گردش خون اغلب علت فوری مرگ است. برای کسانی که بیماری مزمن تنفسی، دستگاه گوارش، یا عصبی ویا هر گونه بیماری چشم و پوست دارند خطرات بیشتری را دارا است. (EPA، 1998) تماس با چشم یا پوست باعث سوختگی شدید میشود، شدت سوختگی بسته به قدرت اسید است. خوردن آن می تواند باعث تحریک شدید دهان و معده گردد. (USCG، 1999) |
Health Hazard Corrosive to all body tissues. Inhalation of vapor may cause serious lung damage. Contact with eyes may result in total loss of vision. Skin contact may produce severe necrosis. Fatal amount for adult: between 1 teaspoonful and one-half ounce of the concentrated chemical. Even a few drops may be fatal if the acid gains access to the trachea. Chronic exposure may cause tracheobronchitis, stomatitis, conjunctivitis, and gastritis. Gastric perforation and peritonitis may occur and may be followed by circulatory collapse. Circulatory shock is often the immediate cause of death. Those with chronic respiratory, gastrointestinal, or nervous diseases and any eye and skin diseases are at greater risk. (EPA, 1998( Contact with eyes or skin causes severe burns, the severity depending on the strength of the acid. Ingestion can cause severe irritation of mouth and stomach. (USCG, 1999( |
||||||||||||||||||||||||
|
اثرات قرار گرفتن در معرض کوتاه مدت این ماده برای چشم، پوست و دستگاه تنفسی بسیار خورنده است.در معرض بلعیدن ممکن است به علت تورم در گلو دچار آسیب دیدگی شود. استنشاق غلظت های بالا باعث ایجاد oedema ریه می شود، اما فقط پس از خوردگی اولیه اثرات بر روی چشم و دستگاه تنفسی فوقانی آشکار شده است. استنشاق ممکن است واکنش های آسم مانند (RADS) ایجاد کند. |
Effects of Short Term Exposure The substance is very corrosive to the eyes, skin and respiratory tract. Corrosive on ingestion Exposure could cause asphyxiation due to swelling in the throat. Inhalation of high concentrations may cause lung oedema, but only after initial corrosive effects on the eyes and the upper respiratory tract have become manifest. Inhalation may cause asthma-like reactions (RADS). |
||||||||||||||||||||||||
|
اثرات قرار گرفتن در معرض طولانی مدت تماس تکراری یا طولانی مدت با پوست ممکن است باعث درماتیت شود. استنشاق مکرر یا طولانی مدت ممکن است بر ریه ها اثر بگذارد. خطر فرسایش دندان پس از تکرار یا طولانی شدن قرار گرفتن در معرض بخارات از این ماده اتفاق می افتد. بخار این اسید معدنی قوی برای انسان ها خطر سرطان زایی دارد. |
Effects of Long Term Exposure Repeated or prolonged contact with skin may cause dermatitis. Repeated or prolonged inhalation may cause effects on the lungs. Risk of tooth erosion upon repeated or prolongated exposure to an aerosol of this substance. Mists of this strong inorganic acid are carcinogenic to humans. |
||||||||||||||||||||||||
|
خطرات آتش سوزی بسیار واکنش پذیر است و در تماس با مواد قابل احتراق رقیق شده قابل اشتعال است. هنگامی که گرم می شود، گازهای بسیار سمی از خود منتشر میکند. ازتماس با گرما؛ آب و مواد آلی اجتناب شود. اسید سولفوریک با مجموعه ای عظیم از مواد ناسازگار است. میتواند در دما و فشار بالا تحت تغییرات شیمیایی شدید قرار گیرد. ممکن است با آب به شدت واکنش نشان دهد. هنگامی که گرم می شود، گازهای بسیار سمی انتشار میدهد. پلیمریزاسیون آن خطرناک است و ممکن نیست رخ دهد. |
Fire Hazard It is highly reactive and capable of igniting finely-divided combustible materials on contact. When heated, it emits highly toxic fumes. Avoid heat; water and organic materials. Sulfuric acid is incompatible with an enormous array of substances. Can undergo violent chemical change at elevated temperatures and pressure. May react violently with water. When heated, it emits highly toxic fumes. Hazardous polymerization may not occur. (EPA, 1998( |
||||||||||||||||||||||||
|
حمل و نقل و انبار از دستورالعمل ERG 137 [مواد - واکنش دهنده آب - خوردگی]: به طور کامل پوشش، لباس محافظ بخار باید برای نشت و نشت بدون آتش استفاده شود. مایع آسیب دیده و یا مواد ریخته شده را لمس نکنید مگر اینکه لباس های محافظ مناسب پوشیده شود. اگر میتوانید بدون خطر، نشت را متوقف کنید. از اسپری آب برای کاهش بخارات استفاده کنید. آب را به طور مستقیم بر روی نشت، محل نشتی یا داخل ظرف آب قرار ندهید. از سوخت های قابل احتراق (چوب، کاغذ، روغن، و غیره) از مواد ریخته شده دور نگه داشته شود. زباله های کوچک: با زمین خشک ، شن و ماسه خشک یا دیگر مواد غیر قابل احتراق و در ادامه ورق های پلاستیکی برای به حداقل رساندن گسترش و یا تماس با باران پوشیده شود. برای جمع آوری مواد و استفاده از ابزارهای تمیز و غیرقابل جابجایی، آن را با ظروف پلاستیکی محکم بپوشانید تا بعدا دفع شود. جلوگیری از ورود به آبراه، فاضلاب، زیرزمین یا مناطق محدود. (ERG، 2016) مواد را دور از منابع آب و فاضلاب نگهداری کنید. ساخت آبراه برای داشتن جریان ضروری است. مواد ریخته شده با سنگ آهک خرد شده، سدیم کربنات و یا آهک خنثی شود. اسپری آب یا بخار آب برای کاهش بخارات اعمال شود. بخار خورنده یا سمی است و باید برای مهار آن ها از آب کافی استفاده شود. دفع زباله: حفر گودال، حوضچه، تالاب، محل نگهداری برای مواد حاوی مایع یا جامد. جریان سطحی با استفاده از خاک، کیسه های شن و ماسه، پلی اورتان فوم یا بتن فوم پوشیده شود. توده مایع با خاکستربادی و یا پودر سیمان جذب شود. با آهک کشاورزی (CaO)، کربنات کلسیم (CaCO3) یا بی کربنات سدیم (NaHCO3) خنثی شود. نشت آب: با آهک کشاورزی (CaO)، کربنات کلسیم (CaCO3) یا بی کربنات سدیم (NaHCO3) خنثی کنید. (AAR، 1999) |
Handling and Storage Excerpt from ERG Guide 137 [Substances - Water-Reactive - Corrosive]: Fully encapsulating, vapor-protective clothing should be worn for spills and leaks with no fire. Do not touch damaged containers or spilled material unless wearing appropriate protective clothing. Stop leak if you can do it without risk. Use water spray to reduce vapors; do not put water directly on leak, spill area or inside container. Keep combustibles (wood, paper, oil, etc.) away from spilled material. SMALL SPILL: Cover with DRY earth, DRY sand or other non-combustible material followed with plastic sheet to minimize spreading or contact with rain. Use clean, non-sparking tools to collect material and place it into loosely covered plastic containers for later disposal. Prevent entry into waterways, sewers, basements or confined areas. (ERG, 2016). Keep material out of water sources and sewers. Build dikes to contain flow as necessary. Neutralize spilled material with crushed limestone, soda ash, or lime. Apply water spray or mist to knock down vapors. Vapor knockdown water is corrosive or toxic and should be diked for containment. Land spill: Dig a pit, pond, lagoon, holding area to contain liquid or solid material. Dike surface flow using soil, sand bags, foamed polyurethane, or foamed concrete. Absorb bulk liquid with fly ash or cement powder. Neutralize with agricultural lime (CaO), crushed limestone (CaCO3) or sodium bicarbonate (NaHCO3). Water spill: Neutralize with agricultural lime (CaO), crushed limestone (CaCO3), or sodium bicarbonate (NaHCO3). ( AAR, 1999( |
||||||||||||||||||||||||
|
شرایط نگهداری خشک. جدا از غذا و مواد خوراکی و مواد ناسازگارنگهداری شود. خطرات شیمیایی را ببینید. فقط در بسته بندی اصلی نگهداری کنید. ظرف را بطور محکم در یک محل خشک و خوب با تهویه مناسب نگه دارید. کانتینرهای باز شده باید به دقت استاندارد شده و جهت جلوگیری از نشت نگهداری شوند. سیگار کشیدن، چراغ های روشن، شعله های آتش و ابزارهای تولید جرقه در نزدیکی carboys اسید سولفوریک مجاز نیست، drums ، مخزن ماشین ها یا مخازن ذخیره سازی فلزی به علت تولید احتمالی مخلوط های انفجاری هیدروژنی در حین ذخیره سازی مجاز نخواهد بود. |
Storage Conditions Dry. Separated from food and feedstuffs and incompatible materials. See Chemical Dangers. Store only in original packaging. Keep container tightly closed in a dry and well-ventilated place. Containers which are opened must be carefully resealed and kept upright to prevent leakage Smoking, open lights, flames, and spark-producing tools shall not be permitted near sulfuric acid carboys, drums, tank cars, or metal storage tanks because of the possible production of explosive mixtures of hydrogen during storage. |
||||||||||||||||||||||||
|
روش های پاکسازی: اقدامات پیشگیرانه در صورت وقوع: اقدامات احتیاطی شخصی، تجهیزات حفاظتی و روش های اضطراری: از ماسک استفاده شود. از تنفس بخارات، غبار یا گاز اجتناب شود. از تهویه مناسب اطمینان حاصل شود. پرسنل به مناطق امن انتقال داده شوند. اقدامات احتیاطی محیط زیست: اجازه ندهید که محصول به فاضلاب برسد. روش ها و مواد برای مهار و تمیز کردن: با مواد جاذب، جذب شده و زباله های خطرناک دفع شود. برای دفع در ظروف مناسب و در بسته نگهداری شود. در زمین: برای نشتی کوچک، منطقه آلوده را با بیکربنات سدیم یا مخلوط سدیم کربنات/ آهک خرد شده (50/50) پوشش داده و مخلوط کنید. محصولات خنثی شده را در ظرف برای دفع کردن انتقال داده شود. اگر عامل خنثی کننده در دسترس نیست، منطقه را با شن و ماسه یا خاک برای جذب مایع پوشش دهید و با بیل به ظروف برای دفع انتقال دهید. در آب: بی کربنات سدیم به عنوان یک ماده خنثی کننده در محل توصیه می شود از اضافه کردن بیش از حد اجتناب شود، زیرا باعث افزایش بیش از حد pH و همچنین تولید گرمای واکنش می شود. سایر عوامل که ممکن است برای خنثی شدن مورد توجه قرار گیرند عبارتند از: دولومیت کالسیک (که در آن قلیائیت بیش از حد قابل کنترل است)، اکسید کلسیم (که در آن قلیا می تواند تحمل شود)، و هیدروکسید کلسیم (جایی که گچ تشکیل و خنثی می کند) و سدیم کربنات (که در آن محتوای کلسیم و منیزیم نگهداری می شود) |
Cleanup Methods: ACCIDENTAL RELEASE MEASURES: Personal precautions, protective equipment and emergency procedures: Wear respiratory protection. Avoid breathing vapors, mist or gas. Ensure adequate ventilation. Evacuate personnel to safe areas. Environmental precautions: Do not let product enter drains. Methods and materials for containment and cleaning up: Soak up with inert absorbent material and dispose of as hazardous waste. Keep in suitable, closed containers for disposal. On Land: For small spills, cover the contaminated area with sodium bicarbonate or a mixture of soda ash/slaked lime (50/50) and mix. Shovel the neutralized residues into containers for disposal. If neutralizing agent is not available, cover the area with sand or earth to absorb the liquid and shovel into containers for disposal. In Water: Sodium bicarbonate is recommended as an in situ neutralizing agent to avoid overdosing, resulting in too great a pH increase as well as the lower heat of reaction. Other treating agents that may be considered for neutralization are: calcined dolomite (where overrun of alkali; can be tolerated), calcium oxide (where overrun of alkali can be tolerated), and calcium hydroxide (where gypsum forms and slows neutralization), and sodium carbonate (where Ca and Mg content are to be kept low). |
||||||||||||||||||||||||
|
مواد ناسازگار: بازها، هالید ها، مواد ارگانیک، کاربید، فولمینات، نیترات، پیکرات، سیانید، کلرات، هالید های قلیایی، نمک های روی، پرمنگنات، به عنوان مثال پرمنگنات پتاسیم، پراکسید هیدروژن، آزید، پرکلرات، نیترومتان، فسفر؛ واکنش شدید با: سیکلوپنتیادیون، سیکلوپنتانون اکسیم، نیترواریل آمینها، دیسیلیکید هگزالیتیوم، اکسید فسفر (iii)، فلزات پودری. |
Incompatible materials: Bases, halides, organic materials, carbides, fulminates, nitrates, picrates, cyanides, chlorates, alkali halides, zinc salts, permanganates, e.g. potassium permanganate, hydrogen peroxide, azides, perchlorates, nitromethane, phosphorous; Reacts violently with: cyclopentadiene, cyclopentanone oxime, nitroaryl amines, hexalithium disilicide, phosphorous(iii) oxide, powdered metals. |
||||||||||||||||||||||||
|
واکنش پذیری بسیار واکنش پذیر، بیشتر فلزات را در خود حل میکند، پتاسیم و سولفوریک اسید: واکنش انفجاری است. پراکسوكرومات نقره و اسید سولفوریک: در تلاش برای تهیه "اسید پركرومیک"، مخلوطی از پراكسوكرومات و نقره (یا باریم) و اسید سولفوریک 50٪ كه در دمای -80 درجه سانتیگراد تهیه شده است، به طور انفجاری واكنش داده شده در دمای 30 تا درجه سانتیگراد گرم می شود. اسید سولفوریک با سدیم به آرامی واکنش نشان می دهند، در حالی که با محلول های آبی با انفجار واکنش نشان می دهند. تالیم آزیدوتیوکربنات و اسید سولفوریک: نمک انفجاری بسیار ناپایدار با تماس با اسید سولفوریک آغاز می شود |
Reactivity Very reactive, dissolves most metals; Potassium and sulfuric acid: Interaction is explosive. Silver peroxochromate and sulfuric acid: In attempts to prepare "perchromic acid," a mixture of silver (or barium) peroxochromate and 50% sulfuric acid prepared at -80 deg C reacted explosively on slow warming to about -30 deg C. Sulfuric acids react slowly with sodium, while the aqueous solutions react explosively. Thallium (I) azidodithiocarbonate and sulfuric acid: The highly unstable explosive salt is initiated by contact with sulfuric acid. |
||||||||||||||||||||||||
|
پایداری/عمر مفید: پایدار در شرایط ذخیره سازی توصیه شده. موارد استفاده:
|
Stability/Shelf Life: Stable under recommended storage conditions. Uses:
|
||||||||||||||||||||||||
|
References
|
|||||||||||||||||||||||||
تهیه شده در واحد پژوهش و گسترش جلاپردازان پرشیا
Prepared by research and development unit of jalapardazan Persia
آذر96
http://www.jalapardazan.com/bank-articeles/health-articles-plating/776-acids-for-plating,-applications,-safety-and-hazards.html
لینک مطلب در سایت نویسنده مقاله
بازدارنده های محلول های اسید شویی
بازدارنده های محلول های اسید شویی
Acid Pickling Inhibitor
مقدمه
اسیدشویی فرآیندی است که غالبا برای برداشتن لایه های اکسیدی و رسوبی از روی فلزات و آلیاژهای مختلف مورد استفاده قرار می گیرد. ازجمله اسیدهایی که بیشترین کاربرد را در این فرآیند دارند. می توان اسید سولفوریک و کلریدریک را نام برد. اگرچه استفاده از اسید سولفوریک بعنوان اسیدی قویتر ارجحیت دارد. ولی اسید کلریدریک به علت زمان بر هم کنش کمتر، بوجود آوردن سطحی شفاف تر و هزینه بازیابی کمتر مورد توجه محققین قرارگرفته است. در فرآیند اسید شویی برای جلوگیری از خورده شدن آلیاژ توسط اسید، مقداری ماده بازدارنده از خوردگی به اینگونه محلولها افزوده میگردد. این بازدارنده ها عموما مواد آلی هستند که شامل نیتروژن ، اکسیژن و یا گوگرد می باشند. آمینهای نوع سوم از جمله ترکیبات آلی نیتروژن داری هستند که بعنوان بازدارنده خوردگی در فرآیند اسید شویی موردمطالعه قرار گرفته اند.
تعریف بازدارنده ها و طبقه بندی آنها
بازدارنده ها موادی هستند که وقتی به مقادیر کم به یک محیط خورنده اضافه گردند، باعث كاهش سرعت خوردگی می شوند. اثر یک بازدارنده بستگی زیادی به محیط اطراف و نوع فلز دارد. این مواد را به روش های مختلف طبقه بندی می کنند که تعدادی از آنها در این مقاله ذکر می شود.
بازدارنده های خطرناک و بی خطر
هر ماده بازدارنده دارای غلظت موثر مشخص و معینی می باشد که در عمل باید با مقادیر کمی بالاتر از آن مورد استفاده قرار گیرد. بازدارنده های بی خطر آنهایی هستند که اگر کمتر از حد بحرانی افزوده شوند، خاصیت بازدارندگی اندکی نشان می دهند. اما بازدارنده های خطر ناک آنهایی هستند که اگر غلظت آنها کمتر از غلظت بحرانی باشد نه تنها باعث حفاظت نمی شوند، بلکه باعث حملات شدید و خوردگی های حفرها می گردند که مقدار آن بیش از حالتی است که اصلا اضافه نشده باشند.
بازدارنده های کاتدی و آندی
این طبقه بندی بر اساس آن كه ماده کندکننده سبب افزایش قطبش واکنش آندی ( کند نمودن حل شدن آهن ) یا واکنش کاتدی ( مثل کم شدن احیا اکسیژن در محلولهای خنثی و یا کاهش تعصید هیدروژن در محلولهای اسیدی ) می شوند، بنا گردیده است.
بازدارنده های اکسیدان و غیر اکسیدان
این تقسم بندی بر مبنای توانایی آنها در روئین سازی فلز می باشد.
بازدارنده های آلی و معدنی
خوردگی
تفاوت خوردگی در محیطهای خنثی و اسیدی
خوردگی فلزات در محیط های خنثی و اسیدی دارای دو اختلاف عمده می باشد. اول آنکه در محیط خنثی عمده ترین واکنش کاتدی، احیاء اکسیژن محلول و تولید یون هیدروکسید میباشد، در حالی که این واکنش در محیط های اسیدی احیاء بودن هیدروژن به گاز هیدروژن است. دوم آنکه در حالت خنثی سطح فلز از فیلمهای اکسیدی، هیدروکسیدها، یا نمک های کم محلول پوشیده می شود ولی در محیط های اسیدی این اکسیدها محلول می باشند. به دلیل این اختلاف مکانیسم، بازدارندههای محیط های خنثی و اسیدی از یکدیگر متمایزند. اساس محافظت و بازدارندگی در محیطهای خنثی، ایجاد ترکیبات پایدار روی سطح فلز می باشد.
تئوري مكانيزم واكنش بازدارندهها در محيط اسيدي
مواد شيميایي بازدارنده موجود در محيط اسيدي، ابتدا روي سطح فلز جذب شده و سپس واكنش شيميايي آغاز ميگردد، كليه بازدارندهها تركيبات غير محلول و يا كم محلول روي سطح فلز ايجاد نموده، به اين ترتيب حفاظت از خوردگي بوسيله لايه محافظ حاصل از واكنش شيميايي فلز بازدارنده و يونهاي محيط خورنده در سطح فلز ميسر ميگردد.
فرآيند انجام واكنش شيميايي ابتدا با سرعت بيشتر به صورت هيدروژن بوده و به تدريج كل سطح فلز را در بر ميگيرد، كه با تكميل شدن فيلم سطحي، سرعت رشد آن نيز كاهش مييابد
نحوه عملکرد بازدارنده های کاتدی و آندی
از آنجا که در محلولهای خنثی واکنش کاتدی عمدتا احیاء اکسیژن و تولید هیدروکسید می باشد، بنابراین باكاهش انتقال اکسیژن به سطح فلز، می توان شدت خوردگی را تا حد زیادی کاهش داد. در این مورد استفاده از نمک های فلزاتی مثل روی، منیزیم، منگنز یا نیکل باعث می شود تا یون این فلزات با یون هیدروکسید تولید شده در کاتد ترکیب شده و هیدروکسیدهای نا محلول ایجاد نمايد که به صورت فیلمی نازک سطح کاتد را بپوشانند. نمک های منیزیم و کلسیم که همواره در آبهای طبیعی حضور دارند نیز ممانعت کننده کاتدی می باشند.
بازدارنده های کاتدی جزء بازدارنده های بی خطر محسوب می شوند. حضور آنیونهای کلرید و سولفات تاثیر چندانی بر آنها نداشته و فیلم تشکیل شده توسط آنها غالبا ضخیم و قابل روئت است. باید توجه نمود که هر گونه کاهش pH یا افزایشCO2محلول می تواند این اثر را از بین ببرد. مکانیسم عمل بازدارنده های آندی بر اساس واکنش یونهای فلزی خورده شده با بازدارنده و ایجاد فیلم محافظ ( روئین ) روی آند میباشد. این گروه شامل آنیونهای اکسیدان نظیر کروماتها، نیتراتها و آنیونهای غیراکسیدان مثل فسفاتها، سیلیکاتها، بنزوات ها و مو لیبداتها میباشند. این مواد در محیطهای خنثی و قلیایی به کار می روند. عواملی مثل در جه حرارت بالا، مقدار زیاد کلرید ها و یا غلظت زیاد یونهای هیدروژن، می توانند سبب ناپایداری لایه و افزایش حلالیت آن شوند. این دسته از بازدارندهها جزء بازدارندههای خطر ناک محسوب می شوند و در صورت ناکافی بودن باعث خوردگی شدید حفرهای می گردند
عوامل موثر در باز دارندگی
ماهیت سطح فلز:
سطوح صاف و تمیز غالبا به بازدارنده کمتری احتیاج دارند، کثیف بودن سطح فلز سبب نرسیدن بازدارنده به سطح فلز شده و راندمان عمل کاهش می یابد. شستشوی شیمیایی، روش مناسبی جهت زدودن این آلودگی ها می باشد.
ماهیت محیط
چنانچه در محیط خورنده، مواد شیمیایی دیگری نیز وجود داشته باشد، باید دقت شود که بازدارنده و آن مواد واکنشهای متقابلی روی هم نداشته باشند. مثلا وقتی از ضد یخ نوع گلیکول استفاده میشود، نباید از کروماتها استفاده نمود. زیرا کروماتها باعث اكسایش ضد یخ شده و ضمن آن کروم شش به کروم سه تبدیل می شود که در نتیجه از قدرت باز دارندگی آنها کاسته خواهد شد. همچنین وجود بعضی از آنیونهای خورنده مثل کلرید و سولفات می تواند قدرت بازدارنده را کاهش و میزان مصرف آنرا افزایش دهد.
غلظت بازدارنده
باید توجه نمود که در اغلب موارد چنانچه غلظت بازدارنده از حد بحرانی کمتر باشد، خود باعث تشدید خوردگی می شود. از جمله این موارد بازدارنده های آنیونی می باشند. به طور کلی سرعت خوردگی در اثر افزایش غلظت بازدارنده ها کم شده و حفاظت افزایش می یابد. اگرچه به ندرت مشاهده شده است که، افزایش زیاد غلظت بازدارنده، سبب تسریع خوردگی ميشود.
pH سیستم
تمام بازدارنده ها در محدوده معینی از pH بیشترین راندمان را دارند و لذا pH محیطهای خنثی باید به طور مرتب کنترل شود. مثلا نیتریت ها قدرت بازدارندگی خود را در pH کمتر از 5/5 از دست می دهند. این مقدار برای پلی فسفات ها 5/7 – 5/6 و برای کروماتها حدود 5/8 می باشد.
درجه حرارت سیستم
به طور کلی سرعت خوردگی با افزایش دما زیاد میشود. معلوم شده است که خوردگی در آب به مقدار زیادی توسط نفوذ اکسیژن به منطقه کاتدی کنترل می شود. واضح است که هر عاملی که روی سرعت نفوذ اثر بگذارد، بر سرعت خوردگی نیز موثر خواهد بود. مشاهده شده است که به ازای هر30 درجه افزایش دما، سرعت خوردگی آهن دو برابر می شود. لذا با افزایش دماي سیستم، غلظت مورد نیاز بازدارنده نیز افزایش می یابد.
اثر میکرو ارگانیسمها
حضور میکروارگانیسمها می تواند سه اثر عمده در محلولهای آبی داشته باشد:
1- برخی از آنها می توانند مستقیما در خوردگی فلزات شرکت کنند. مثل باکتریهای احیا کننده سولفات در محیط غیر هوازی یا باکتریهای آهن خوار در محیط های هوازی. نتیجه این فعالیت، تجمع با کتریها در یک محل و ایجاد خوردگی حفره ای می باشد.
2- از بین رفتن و مصرف بازدارنده توسط باکتریها.
3- ایجاد لجن ناشی از تجمع میکروارگانیسمها، تقلیل جریان آب در لوله و رشد و نمو جلبکها.
(بسیاری از بازدارنده ها خواص خود را در حضور یک یا چند عامل فوق از دست می دهند. در چنین حالتی ضروری است که از باکتری کشهای مناسب، استفاده نمود.)
اختلاط بازدارنده ها
اغلب استفاده از مخلوط چند بازدارنده، نتایج مطلوبتری ارائه می دهد. مثلا مخلوطی از بازدارندههای کاتدی نظیر نمکهای فلزاتی مثل روی، منیزیم و... و بازدارنده های آندی مثل آنیونهای کرومات، فسفات و نیتریت، باعث افزایش قابل ملاحظه ضریب بازدارندگی می شوند.
تركيب شيميايي بازدارندهها
تركيبات زيادي يافته شده اند كه در اسيدها اثر بازدارندگي از خوردگي دارند. اين مواد از يونهايهاليد گرفته تا موادي با وزنهاي مولكولي زياد مثل نشاسته هستند و در شكل از جامدات تا گازها ميباشند. تركيبات آلي خواص بهتري دارند، خصوصاً آنهايي كه داراي عناصر گروههاي 5 و 6 جدول تناوبي هستند (مثل N ، P ، As ، O ، S). اين تركيبات آلي ممكن است داراي راديكالهاي آليل و يا آريل و گروههاي غير اشباع يا اشباع باشند. بطور تجربي ديده شده است كه خواص بازدارندگي در سريهاي مشابه بر حسب اينكه فرضاً زنجير آليل مستقيم است يا شاخه دار فرق ميكند. گاز استيلن در محيطهاي اسيدي روي فولاد اثر بازدارندگي دارد. پروپارجيل الكل در تركيب بسياري از بازدراندههاي تجاري وجود دارد.
کلریدریک اسید مشخصات
هیدروکلریک اسید یک محلول شفاف، بیرنگ و بسیار تند بو از هیدروژن کلرید (HCl) در آب است. یک اسید معدنی بسیار خوردنده و یک اسید قوی با استفادههای صنعتی زیادی است. هیدروکلریک اسید به طور طبیعی در اسید معده یافت میشود. پیاچ (pH) این اسید بین ۰ تا ۲۲ میباشد.
هیدروکلریک اسید از قدیم به نامهای اسیدم سالیس، موریاتیک اسید و ارواح نمک معروف بوده و از ویتریول (سولفوریک اسید) و نمک طعام به دست آمد. هیدروکلریک اسید آزاد ابتدا در قرن شانزدهم توسط آندریاس لیباویوس رسماً معرفی شد. بعدتر، توسط شیمیدانهایی مثل ژوهان رودولف گلابر، جوزف پریستلی و همفری دیوی در تحقیقات علمی شان مورد استفاده قرار گرفت.
با آغاز تولید گسترده در انقلاب صنعتی، هیدروکلریک اسید در صنایع شیمیایی بعنوان یک واکنش گر ناب در تولید مقیاس بزرگ وینیل کلرید برای پلاستیک PVC، و MDI/TDI برای پلی یورتان مورد استفاده قرار گرفت. کاربریهای زیادتری هم در مقیاس کوچک دارد که شامل خانهداری، ساخت ژلاتین و دیگر افزودنیهای غذایی، رسوبزدایی و چرم سازی میباشد. حدود ۲۰ میلیون تن از هیدروکلریک اسید سالانه در جهان تولید میشود.
همچنین گفته میشود جابر بن حیان این اسید را کشف کرده است. ازاین اسید برای جرم گیری از سطوح مختلف استفاده میشود. هیدروکلریک اسید در معده نیزوجود دارد و به هضم غذا کمک میکند. تنفس بخارات هیدروکلریک اسید خطرناک است و به دستگاه تنفسی آسیب میرساند و اگر قطرهای از آن بر روی پوست بدن بچکد تولید تاول و حتی جراحات عمیق مینماید ودرچنین مواردی باید بلافاصله با محلول قلیایی رقیق مانند محلول سودا یا جوش شیرین اثر اسید را خنثی کرد.
محتویات
۱وجه تسمیه۲تاریخچه
۳خواص شیمیایی و واکنشها
۴خواص فیزیکی
۵تولید
۵.۱بازار صنعتی
۶کاربردها
۶.۱اسیدشویی فولاد
۶.۲تولید ترکیبات آلی
۶.۳تولید ترکیبات غیرآلی
۶.۴کنترل pH و خنثی سازی
۶.۵بازسازی مبدلهای یونی
۶.۶دیگر کاربرد های هیدروکلریک اسید
۷حضور در موجودات زنده
۸ایمنی
۹جستارهای وابسته
۱۰پیوند به بیرون
۱۱منابع
وجه تسمیه
هیدروکلریک اسید برای کیمیاگران اروپایی با عنوان ارواح نمک یا اسیدم سالیس (نمک اسید) شناخته شده بود. هر دو نام هنوز هم رایج هستند به خصوص در زبانهای غیر انگلیسی مثل زبان آلمانی: Salzsäure، زبان هلندی: Zoutzuur، زبان سامی شمالی: Saltsyra و زبان لهستانی: kwas solny. HCl گازی هوای اسید دریایی نامیده میشد. نام قدیمی (قبل از نام قاعده دار) موریاتیک اسید نیز ریشهٔ یکسانی دارد و بعضی اوقات به کار میرود (موریاتیک یعنی "مربوط به آب نمک یا نمک").[۱][۲]نام «هیدروکلریک اسید» توسط شیمیدان فرانسوی ژوزف لویی گیلوساک در ۱۸۱۴ ابداع شد.[۳]
تاریخچه
تیزاب سلطانی، مخلوطی از هیدروکلریک اسید و نیتریک اسید، که با حل شدن نشادر در نیتریک اسید تهیه میشود، توسط سئودو گبر (جابر بن حیان بدلی)، شیمیدان اروپایی قرن ۱۳ تشریح شد.[۴][۵][۶][۷][۸] دیگر مراجع اذعان دارند که اولین اشاره به تیزاب سلطانی در دست خطهای موجود امپراتوری روم شرقی با تاریخ اواخر قرن سیزدهم یافت شده است.[۹][۱۰][۱۱]
هیدروکلریک اسید آزاد اولین بار به صورت رسمی در قرن ۱۶ توسط آندریاس لیباویوس معرفی شده است که آن را با گرم کردن نمک در بوته چینی خاک رسی به دست آورد.[۱۲] دیگر نویسندگان ادعا میکنند که هیدروکلریک اسید خالص اولین بار توسط کاهن بندیکتی باسیل والنتین آلمانی در قرن ۱۵،[۱۳] با گرم کردن نمک طعام معمولی و آهن(II) سولفات کشف شده است.[۱۴] درحالیکه دیگران مدعی اند که هیچ مرجع قابل اعتمادی راجع به اینکه هیدروکلریک اسید خالص تا اواخر قرن شانزدهم به دست آمده باشد، وجود ندارد.[۱۵]
در قرن هفدهم، ژوهان رودولف گلابر از کارل اشتات آم ماین از نمک سدیم کلرید و سولفوریک اسید برای تهیهٔ سدیم سولفات در واکنش مانهایم استفاده کرد که گاز هیدروژن کلرید آزاد میکرد. جوزف پریستلی از لیدز انگلستان، هیدروژن کلرید خالص را در ۱۷۷۲ تهیه کرد،[۱۶] و در ۱۸۰۸ همفری دیوی از پزانس انگلستان، ثابت کرده بود که ترکیب شیمیایی شامل هیدروژن و کلر بوده است.[۱۷]
همزمان با انقلاب صنعتی در اروپا، تقاضا برای مواد قلیایی افزایش یافت. فرایند جدیدی توسط نیکولاس لبلانک (ایسودان، فرانسه) تولید ارزان قیمت و گستردهٔ سدیم کربنات (جوش شیرین) را ممکن کرد. در این فرایند لبلانک، نمک طعام با استفاده از سولفوریک اسید، سنگ آهک و زغال سنگ ضمن آزاد کردن هیدروژن کلرید به عنوان فرآوردهٔ جانبی، به جوش شیرین تبدیل میشود. تا زمان قانون قلیایی ۱۸۶۳ در برتانیا و قوانین مشابه در دیگر کشورها، HCll اضافی وارد هوا میشد. بعد از قانون گذاری، تولیدکنندگان جوش شیرین مجبور به انتقال گاز اتلافی به آب و جذب آن در آب شدند تا هیدروکلریک اسید در مقیاس صنعتی تولید کنند.[۱۸]
در قرن بیستم، فرایند لبلانک جای خود را به فرایند سولوای که فرآوردهٔ جانبی هیدروکلریک اسید تولید نمیکرد و موثرتر بود، داد. به خاطر آن که هیدروکلریک اسید همچنان بعنوان یک ماده شیمیایی مهم در کاربردهای متعدد شناخته میشد، میل تجاری روشهای تولید دیگری را نیز موجب شد که برخی همچنان به کار گرفته میشوند. بعد از سال ۲۰۰۰، هیدروکلریک اسید بیشتر با جذب هیدروژن کلرید اضافی از تولید ترکیبات آلی صنعتی تولید میگردد.[۱۸]
از ۱۹۸۸، هیدروکلریک اسید با عنوان پیشرو در جدول دوم پیمان نامه سازمان ملل علیه خرید و فروش غیرقانونی مواد مخدر و مواد روانگردان در سال ۱۹۸۸ به علت استفاده از آن در تولید و ساخت هروئین، کوکائین و مت آمفتامین ذکر شده است.[۱۹]
خواص شیمیایی و واکنشها
هیدروژن کلرید (HCl) اسید تک پروتونی است، به این معنی که میتواند فقط یک بار تفکیک شود (مثلا یونیزه) تا یک یون H+ (یک پروتون تنها) آزاد کند. در هیدروکلریک اسید آبی، H+ به یک مولکول آب میپیوندد تا یک یون هیدرونیوم، H3O+ تشکیل دهد:[۲۰][۲۱]
- HCl + H2O → H3O+ + Cl−
دیگر یون تشکیل شده Cl−، یون کلرید است؛ بنابراین هیدروکلریک اسید میتواند برای تهیه نمکهای کلرید، مثل سدیم کلرید به کار رود. هیدروکلریک اسید یک اسید قوی است چون در اصل به طور کامل در آب تفکیک میشود.
اسیدهای تک پروتون دار یک ثابت تفکیک اسیدی، Ka، دارد که نشانگر میزان تفکیک در آب است. برای یک اسید قوی مثل HCl، مقدار Ka بزرگ است. تلاشهای نظری برای اختصاص یک Ka به HCl انجام پذیرفتهاند.[۲۲] وقتی نمکهای کلرید مثل NaCl به HCl آبی اضافه میشوند، عملاً تأثیری بر pH ندارند، این یعنی که Cl− یک باز مزدوج بسیار ضعیف است و HCl کاملاً در محلول آبی تفکیک شده است. برای محلولهای متوسط تا قوی هیدروکلریک اسید، فرض اینکه مولاریتهی H+ (یک یکای غلظت) دقیقاً برابر با مولاریتهٔ HCl است، با توجه به چهار رقم معنی دار درست است.
از بین شش اسید معروف قوی از اسیدهای معدنی در شیمی، هیدروکلریک اسید، یک پروتون دارد و کمترین تمایل را به شرکت در یک واکنش اکسایش-کاهش دارد. برخلاف اسیدی بودن آن، یکی از کم خطرترین اسیدها برای استفاده است زیرا شامل یون کلرید واکنش ناپذیر و غیر سمی است. محلولهای نسبتاً قوی هیدروکلریک اسید ضمن نگهداری شان کاملاً پایدار هستند و غلظت آنها در زمان ثابت میماند. این ویژگیها به علاوهٔ این که به عنوان یک واکنشگر ناب خالص در دسترس است، هیدروکلریک را به یک واکنش گر اسیدی عالی مبدل میسازد.
هیدروکلریک اسید یک اسید مطلوب در تیتراسیون برای تعیین مقدار بازها است. تیترانتهای اسید قوی نتایج دقیق تری به خاطر نقطه پایانی متمایزشان میدهند. آزئوتروپ یا (محلول نقطه جوش ثابت) هیدروکلریک اسید (تقریبا ۲۰٫۲٪) را میتوان به عنواناستاندارد اولیه در تحلیلهای کمی به کار برد اگرچه، غلظت دقیق آن به فشار جوی که در آن تهیه شده است، بستگی دارد.[۲۳]
استفاده از هیدروکلریک اسید در شیمی تجزیه برای تهیه محلولها (ی "ساده") جهت تجزیه بسیار رایج است. هیدروکلریک اسید غلیظ گاز هیدروژن، کلریدهای فلز اکسید شده و فلزهای زیادی را در خود حل میکند و با ترکیبهای بازی مثل سدیم کربنات یامس (II) اکسید واکنش داده و کلریدهای حل شدهای را ترکیب میکند که قابل تحلیل هستند.
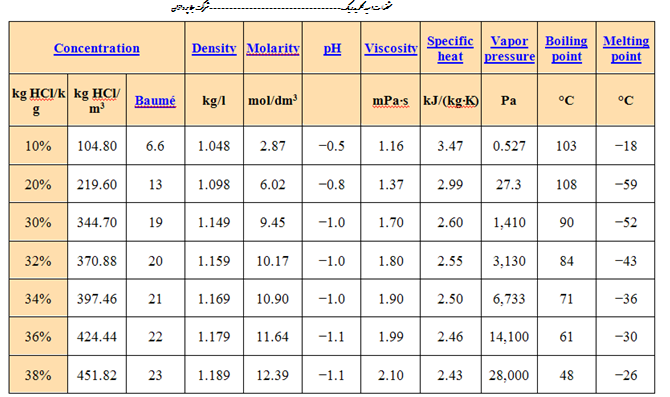
خواص فیزیکی
| غلظت | چگالی | غلظت مولار | پیاچ | گرانروی | ظرفیت گرمایی | فشار بخار | نقطه جوش | دمای ذوب | ||
|---|---|---|---|---|---|---|---|---|---|---|
| kg HCl/kg | kg HCl/m3 | Baumé | kg/L | mol/dm3 | mPa•s | kJ/(kg•K) | kPa | °C | °C | |
| ۱۰٪ | ۱۰۴٫۸۰ | ۶٫۶ | ۱٫۰۴۸ | ۲٫۸۷ | −۰٫۵ | ۱٫۱۶ | ۳٫۴۷ | ۱٫۹۵ | ۱۰۳ | −۱۸ |
| ۲۰٪ | ۲۱۹٫۶۰ | ۱۳ | ۱٫۰۹۸ | ۶٫۰۲ | −۰٫۸ | ۱٫۳۷ | ۲٫۹۹ | ۱٫۴۰ | ۱۰۸ | −۵۹ |
| ۳۰٪ | ۳۴۴٫۷۰ | ۱۹ | ۱٫۱۴۹ | ۹٫۴۵ | −۱٫۰ | ۱٫۷۰ | ۲٫۶۰ | ۲٫۱۳ | ۹۰ | −۵۲ |
| ۳۲٪ | ۳۷۰٫۸۸ | ۲۰ | ۱٫۱۵۹ | ۱۰٫۱۷ | −۱٫۰ | ۱٫۸۰ | ۲٫۵۵ | ۳٫۷۳ | ۸۴ | −۴۳ |
| ۳۴٪ | ۳۹۷٫۴۶ | ۲۱ | ۱٫۱۶۹ | ۱۰٫۹۰ | −۱٫۰ | ۱٫۹۰ | ۲٫۵۰ | ۷٫۲۴ | ۷۱ | −۳۶ |
| ۳۶٪ | ۴۲۴٫۴۴ | ۲۲ | ۱٫۱۷۹ | ۱۱٫۶۴ | −۱٫۱ | ۱٫۹۹ | ۲٫۴۶ | ۱۴٫۵ | ۶۱ | −۳۰ |
| ۳۸٪ | ۴۵۱٫۸۲ | ۲۳ | ۱٫۱۸۹ | ۱۲٫۳۹ | −۱٫۱ | ۲٫۱۰ | ۲٫۴۳ | ۲۸٫۳ | ۴۸ | −۲۶ |
| دما و فشار مرجع برای جدول فوق ۲۰˚C و ۱ اتمسفر (101.325 kPa) است. مقادیر فشار بخار از جداول بینالمللی بحرانی اخذ شدهاند و همان فشار بخار کل محلول هستند. | ||||||||||

خواص فیزیکی هیدروکلریک اسید، مثل نقطه جوش و دمای ذوب، چگالی و pH بستگی به غلظت یا مولاریته HCl در محلول آبی دارند که از خواص آب در غلظتهای نزدیک به ۰٪ اسید تا مقادیر بخاری هیدروکلریک اسید در بیش از 40% HCl متغیر هستند.[۲۶]
هیدروکلریک اسید به عنوان مخلوط دوتایی (دو جزئی) از HCl و H2O آزئوتروپ نقطه جوش ثابتی در 20.2% HCl و ۱۰۸٫۶ ˚F (227 ˚F) دارد. چهار نقطه اوتکتیک ثابت بلوری شدن برای هیدروکلریک اسید، بین شکلهای بلور HCl•H2O (68% HCl)، HCl•2H2O (51% HCl)، HCl•3H2O (۴۱٪)، HCl•6H2O (25% HCl) و یخ (0% HCl) وجود دارد. هم چنین نقطه ثابت اوتکتیک در ۲۴٫۸٪ بین یخ و بلور HCl•3H2O موجود است.
تولید
هیدروکلریک اسید با حل شدن هیدروژن کلرید در آب تهیه میشود. هیدروژن کلرید را میتوان با روشهای گوناگونی تولید کرد و این یعنی راههای زیادی برای ساخت هیدروکلریک اسید موجودند. تولید مقیاس بزرگ هیدروکلریک تقریباً همیشه با تولید در مقیاس صنعتی دیگر مواد شیمیایی انجام میپذیرد.
بازار صنعتی
هیدروکلریک اسید در محلولهای تا ۳۸٪ از HCl (مقدار غلیظ) تهیه میشود. غلظتهای بیشتر فقط تا ۴۰٪ از نظر شیمیایی قابل تولید هستند، اما نرخ تبخیر از آن به بعد به قدری بالا است که نگهداری و استفاده از آن نیازمند ملاحظات اضافی تری است مثل دما و فشار پایین. پس میزان عمدهٔ صنعتی آن ۳۰٪ تا ۳۴٪ است که با توجه به حمل و نقل مناسب و اتلاف مادهٔ محدود به علت بخارهای HCl بهینه شده است. غلظتهای بیشتر را به جهت کنترل اتلاف از طریق تبخیر باید فشرده و سرد نمود. در ایالات متحده، محلولهای بین ۲۰٪ تا ۳۲۲٪ با نام اسید موریاتیک فروخته میشوند. محلولهای مورد استفاده اغلب برای نظافت خانهها در ایالات متحده، معمولاً ۱۰٪ تا ۱۲۲٪ هستند که هشدارهای جدی برای رقیقتر کردن شان قبل از استفاده دارند. در بریتانیا، که با نام «ارواح نمک» برای نظافت خانگی فروخته میشود، قدرت اسید برابر همان مقدار در ایالات متحده است.
تولید کنندگان بزرگ جهانی شامل شرکت داو کمیکال ۲ میلیون تن در سال از HCl گازی، شرکت جرجیا گالف، شرکت توسوه، آکزونوبل و تساندرلو بین ۰٫۵ تا ۱٫۵ میلیون تن در سال تولید دارند. تولید کل جهان، که برای استفادههای آماری بر اساس میزان HCl توصیف شده است، حدود ۲۰ میلیون تن در سال تخمین زده میشود که ۳ میلیون تن از طریق تولید مستقیم و مابقی از طریق استفاده از ترکیبهای آلی و مشابه و تولید فرآوردهٔ ثانوی تأمین میگردند. تا کنون، غالب هیدروکلریک اسید منحصراً توسط تولید کننده مصرف میشود. میزان آن در بازار آزاد جهانی ۵۵ میلیون تن در سال تخمین زده میشود.
کاربردها
هیدروکلریک اسید یک اسید قوی غیر آلی است که در اکثر فرآیندها مثل پالایش فلزات به کار میرود. استفادهٔ مورد نظر معمولاً کیفیت محصول مورد نیاز را نشان میدهد.
اسیدشویی فولاد
یکی از مهمترین استفادههای هیدروکلریک اسید در اسیدشویی فولاد است تا زنگ یا اکسید آهن را از روی آهن یا فولاد قبل از ورود آنها به واکنشهای بعدی مثل اکستروژن، نورد، "گالوانی کردن و دیگر تکنیکها، بزداید. HCl در کیفیت فنی با غلظت معمولاً ۱۸٪ رایجترین عامل اسیدشویی برای اسیدشویی فولادهای کربنی است.
- Fe2O3 + Fe + 6 HCl → 3 FeCl2 + 3 H2O
اسید مصرف شده استفادهٔ بسیاری در محلولهای کلرید آهن (II) (هم چنین معروف به فررو کلرید) دارد اما مقادیر بالای فلزات سنگین در مایع اسیدشویی این عملیات را با مشکل مواجه کرده است.
صنعت اسیدشویی فولاد فرآیندهای بازسازی هیدروکلریک اسید را بهبود بخشیده است، مثل فرایند بازسازی HCl سرخ کنندهٔ اسپری یا بستر سیال که بازیافت HCl را از مایع اسیدشویی مصرف شده ممکن میسازد. رایجترین فرایند بازسازی فرایند پیروهیدرولیز طی واکنش زیر است:
- 4 FeCl2 + 4 H2O + O2 → 8 HCl+ 2 Fe2O3
با بهبودی اسید مصرف شده یک حلقه اسیدی بسته ساخته میشود. فرآوردهٔ جانبی اکسید آهن (II) از واکنش بازسازی باارزش است چون در بسیاری از صنایع ثانوی به کار میرود.
تولید ترکیبات آلی
دیگر استفاده مهم هیدروکلریک اسید در تولید ترکیبات آلی، مثل وینیل کلرید و دی کلرواتان برای پلی وینیل کلراید (PVC) است. معمول این کار یک استفادهٔ غیرآزاد است زیرا مصرف محلی هیدروکلریک اسید تولید شده در واقع به بازار آزاد نمیرسد. دیگر ترکیبات آلی تولید شونده توسط هیدروکلریک اسید عبارتند از بیسفنول ای برای پلی کربنات، کربن فعال و اسید اسکوربیک مثل تولیدات متعدد داروهای شیمیایی.
- 2 CH2=CH2 + 4 HCl + O2 → 2 ClCH2CH2Cl + 2 H2O (دی کلرواتان توسط اکسی کلری شدن)
چوب + HCl + حرارت ← کربن فعال (فعال سازی شیمیایی)
تولید ترکیبات غیرآلی
محصولات زیادی توسط هیدروکلریک اسید طی یک واکنش اسید و باز طبیعی منجر به ترکیبات معدنی (غیرآلی) تولید میشوند و هم چنین مواد شیمیایی درگیر با آب مثل کلرید آهن (III) و پلی آلومینیوم کلراید (PAC).
- Fe2O3 + 6 HCl → 2 FeCl3 + 3 H2O (کلرید آهن (III) از مگنتیت)
کلرید آهن (III) و PAC هر دو بعنوان عوامل لخته سازی و انعقاد در تصفیه آب و فاضلاب، تولید آب آشامیدنی و تولید کاغذ به کار میروند. دیگر ترکیبات معدنی تولید شونده با هیدروکلریک اسید شامل کلرید کلسیم، نمک پخش در جاده، کلرید نیکل (II) برای آبکاری الکتریکی و کلرید روی برای صنعتگالوانی کردن و تولید باتری هستند.
- CaCO3 + 2 HCl → CaCl2 + CO2 + H2O (کلرید کلسیم از سنگ آهک)
کنترل pH و خنثی سازی
هیدروکلریک اسید هم چنین برای تنظیم اسیدی بودن (pH) محلولها به کار میرود.
- OH− + HCl → H2O + Cl−
در خلوص مورد نیاز صنایع (غذایی، دارویی، آب آشامیدنی)، هیدروکلریک اسید با کیفیت برای تنظیم pH فرایند جریانهای آبی مورد استفاده قرار میگیرد. در صنایع کم تقاضا، هیدروکلریک اسید با کیفیت فنی برای خنثی سازی جریانهای اتلافی و مراقبت از استخر شنا به کار گرفته میشود.
بازسازی مبدلهای یونی
هیدروکلریک اسید پر کیفیت در بازسازی یک رزین مبدل یون به کار گرفته میشود. تبادل کاتیون به طور گسترده برای حذف یونهایی مثل Na+ و Ca2+ از محلولهای آبی در تولید آب معدنی شده مورد استفاده قرار میگیرد. اسید برای شستن کاتیونها از رزینها به کار میرود. Na+ با H و Ca2+ با 2HHجایگزین میشود.
مبادله میشوند. مبدلهای یونی و آب معدنی در تمام صنایع شیمیایی، تولید آب آشامیدنی و اکثر صنایع غذایی مورد استفاده قرار میگیرند.
دیگر کاربرد های هیدروکلریک اسید
هیدروکلریک اسید در تعداد زیادی از کاربریهای مقیاس کوچک مثل فرایند چرم سازی، خالص سازی نمک طعام، نظافت و خانهداری،[۲۷] و بنای ساختمانها به کار میرود. تولید نفت را میتوان با تزریق هیدروکلریک اسید در بستر صخرهای یک چاه نفت، حل کردن یک بخش از صخره و ساختن یک منفذ بزرگ تحریک کرد. اسیدزنی چاه نفت یک فرایند معمول در صنعت تولید نفت دریای شمال است.
هیدروکلریک اسید برای حل کردن کلسیم کربنات نیز به کار میرود به عنوان مثال برای پوسته پوسته کردن کتریها و برای پاک کردن ملات از آجرکاریها. البته یک مایع خطرناک است که باید با دقت کافی از آن استفاده کرد. ضمن استفاده روی یک آجرکاری، واکنش آن با ملات تا جایی که کل اسید تبدیل شود ادامه مییابد و کلسیم کربنات، کربن دی اکسید و آب را به همراه دارد:
2HCl + CaCO3 → CaCl2 + CO2 + H2O
اکثر واکنشهای شیمیایی هیدورکلریک اسید در تولید غذا، مواد تشکیل دهنده غذا و افزودنیهای غذایی به کار گرفته میشوند. محصولات رایج عبارتند از آسپارتام، فروکتوز، سیتریک اسید، لیزین، پروتئین گیاهی هیدرولیز شده با اسید به عنوان مقوی غذایی، و در تولید ژلاتین. هیدروکلریک اسید مورد استفاده در صنایع غذایی (خیلی خالص) را میتوان موقع نیاز برای محصول نهایی به کار برد.
در سیاره زهره ابرهایی از هیدروکلریک اسید با غلظت کم وجود دارد.
حضور در موجودات زنده

اسید معده یکی از ترشحات اصلی معده است و به طور عمده شامل هیدروکلریک اسید بوده و محتوای معده را طوری اسیدی میکند که پی اچ بین ۱ و ۲ داشته باشد.[۲۸][۲۹]
یونهای کلرید (Cl−) و هیدروژن (H+) در ناحیهٔ بالایی معده توسط یاخته جداری از مخاط اسید معده ترشح میشوند و به سمت یک شبکهٔ ترشحی به نام کانالیکولی قبل از اینکه وارد حفره پایینی معده شوند، هدایت میشوند.[۳۰]
اسید معده مانند یک سد مقابل ریزاندامهها برای جلوگیری از عفونتها ظاهر میشود و برای هضم غذا اهمیت زیادی دارد. پی اچ پایین آن پروتئینها را دناتوره میکند و در نتیجه آنها را برای تخریب توسط آنزیمهای گوارشی مثل پپسین حساس میکند. پی اچ پایین هم چنین آنزیم پیشروی پپسینوژن را فعال و تبدیل به آنزیم فعال پپسین (با خودشکافی) میکند. بعد از ترک معده، هیدروکلریک اسید کیموس توسط سدیم بی کربنات در دوازدهه خنثی میشود.
خود معده با ترشح لایهٔ ضخیم مخاط، و با سکرتین ناشی از محلول بافر سدیم بی کربنات در مقابل این اسید قوی از خود محافظت میکند. سوزش یر دل یا زخم معده وقتی این مکانیزمها دچار مشکل شوند، رخ میدهند. داروهای آنتی هیستامین و دستههای مهارکنندههای پروتون پمپ میتوانند تولید اسید در معده را مهار کنند، و آنتاسیدها نیز برای خنثی تر کردن اسید موجود مورد استفاده قرار میگیرند.[۳۱]
ایمنی
| غلظت بر حسب وزن | طبقهبندی[۳۲] | کد ایمنی |
|---|---|---|
| ۱۰–۲۵٪ | محرک (Xi) | R36/37/38 |
| > ۲۵٪ | خورنده (C) | R۳۴ R۳۷ |
هیدروکلریک اسید غلیظ (هیدروکلریک اسید بخار) مههای اسیدی تشکیل میدهد. مه و محلول هر دو تأثیر خورنده بازگشت ناپذیری بر بافت انسان با قابلیت تخریب اندامهای تنفسی، چشمها، پوست و رودهها دارند. پس از اختلاط هیدروکلریک اسید بامواد شیمیایی اکسید کنندهٔ معمول مثل سدیم هیپوکلریت (سفیدکننده، NaClO) یا پتاسیم پرمنگنات (KMnO4)، گاز سمی کلر تولید میشود.
- NaClO + 2 HCl → H2O + NaCl + Cl2
- 2 KMnO4 + 16 HCl → 2 MnCl2 + 8 H2O + 2 KCl + 5 Cl2
تجهیزات ایمنی مثل دستکشهای لاستیکی یا PVC، عینکهای ایمنی محافظ چشم و کفشها و لباسهای مقاوم در برابر مواد شیمیایی برای به حداقل رساندن خطرات استفاده از هیدروکلریک اسید به کار میروند. آژانس حفاظت محیط زیست ایالات متحده آمریکا هیدروکلریک اسید را یک مادهٔ سمی معرفی کرده و مقررات آن را تنظیم مینماید.[۳۳]
شماره بینالمللی کالاهای خطرناک یا شمارهٔ وزارت ترابری آمریکا (DOT) آن ۱۷۸۹ است. این شماره روی یک پلاکارد بر روی محفظه نمایش داده میشود.
| شناساگرها | |
|---|---|
| شماره ثبت سیایاس | ۷۶۴۷–۰۱-۰ |
| شمارهٔ آرتیئیسیاس | MW4025000 |
| خصوصیات | |
| فرمول مولکولی | HCl in آب (H2O) |
| جرم مولی | 36.46 g/mol (HCl) |
| شکل ظاهری | Clear colorless to light-yellow liquid |
| چگالی | 1.18g/cm3 |
| دمای ذوب | −27.32 °C (247 K) 38% solution. |
| دمای جوش |
110 °C (383 K)
20.2% solution; 48 °C (321 K) 38% solution. |
| انحلالپذیری در آب | Miscible. |
| اسیدی (pKa) | −8.0 |
| گرانروی | 1.9 mPa·s at 25 °C 31.5% solution |
| خطرات | |
| MSDS | External MSDS |
| طبقهبندی ئییو | |
| کدهای ایمنی | R۳۵, R۳۷ |
| شمارههای نگهداری | S26, S۳۶, S45 |
| خطرات اصلی | Corrosive |
| لوزی آتش |
 0
3
1
COR
|
| نقطه اشتعال | Non-flammable. |
| ترکیبات مرتبط | |
| دیگر آنیونها | F- Br- I- |
| مرتبط با acids | هیدروبرومیک اسید هیدروفلوئوریک اسید هیدروژن یدید سولفوریک اسید |
اسید کرومیک مشخصات
اسید کرومیک (به انگلیسی: Chromic acid) یک ترکیب شیمیایی با شناسه پابکم ۲۴۴۲۵ است. شکل ظاهری این ترکیب، بلورهای قرمز است.
| شناساگرها | |
|---|---|
| شماره ثبت سیایاس | 7738-94-5 |
| پابکم | 24425 |
| کماسپایدر | 22834 |
| شمارهٔ ئیسی | 231-801-5 |
| ChEBI | CHEBI:33143 |
|
مرجع جیملین
|
25982 |
| جیمول-تصاویر سه بعدی | Image 1 Image 2 |
| خصوصیات | |
| فرمول مولکولی | H2CrO4 |
| جرم مولی | ۱۱۸٫۰۱ g mol−1 |
| شکل ظاهری | Red crystals |
| چگالی | 1.201 g cm-3 |
| دمای ذوب | ۱۹۷ درجه سلسیوس (۳۸۷ درجه فارنهایت; ۴۷۰ کلوین) |
| دمای جوش |
250 °C, 523 K, 482 °F decomposes
|
| انحلالپذیری درآب | 1666.6 g dm-3 |
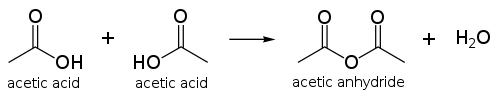
استیک اسید مشخصات
اسید استیک یا نام آیوپاک آن اتانوئیک اسید، جوهر انگور یا جوهر سرکه جز اسیدهای آلی (از گروه کربوکسیلیک اسیدها) است. فرمول آن CH3COOH است.
محتویات
۱نگاه کلی
۲نامگذاری
۳تاریخچه
۴خواص شیمیایی
۵حلال
۶واکنشهای شیمیایی
۷شناسایی
۸بیوشیمی
۹تولید
۹.۱روشهای تولید صنعتی اسید اسیتیک
۱۰کربندارکردن متانول
۱۱اکسایش استالدئید
۱۲اکسایش اتیلن
۱۳تخمیر
۱۴کاربردها
۱۵استات وینیل تکپاره
۱۶تولید استر
۱۷آنیدرید استیک
۱۸سرکه
۱۹کاربرد به عنوان حلال
۲۰سایر کاربردها
۲۱ایمنی
۲۲جستارهای وابسته
۲۳منابع
۲۴پیوند به بیرون
۲۵پانویس
نگاه کلی
اسید استیک جز اسیدهای کربوکسیلیک میباشد و در نامگذاری آیوپاک به اسید اتانوئیک معروف است. این اسید دارای فرمول شیمیایی میباشد و در قسمت چشایی طعم ترشی، شبیه طعم سرکه میدهد.
این اسید یک اسید ضعیف بوده زیرا تنها مقداری اسید جدا شده در محلول آبی می باشد. استیک اسید بدون آب و خالص (استیک اسید یخی) یک مایع بدون رنگ بوده که آب را از محیط اطرافش جذب میکند(هیگروسکوپی) و در دمای 16.5 C(62 F) به شکل یک جامد کریستالی بی رنگ منجمد می شود. اسید خالص و محلول های غلیظ آن بسیار خورنده هستند.
استیک اسید یکی از ساده ترین کربکسیلیک اسید ها است. این اسید یک معرف شیمیایی مهم بوده و یک ماده شیمیایی صنعتی مورد استفاده در تولید مواد زیر است: پلی اتیلن ترفتالات که به صورت عمده در بطری های نوشابه استفاده می شود؛ سلولوز استات که به طور عمده در فیلم عکاسی استفاده می شود؛ پلی وینیل استات برای چسب چوب به علاوه فایبر ها و فابریک های مصنوعی. در خانه، استیک اسید رقیق برای بازکردن لوله ها استفاده می شود. در صنعت غذا، استیک اسید تحت کد افزودنی E2600 به عنوان تنظیم اسیدی و به عنوان چاشنی استفاده می شود.
تقاضای جهانی استیک اسید در حدود 6.5 میلیون تون در سال (Mt/a) که حدود 1.5 Mt/a از طریق بازیافت برآورده می شود. باقی آن توسط بازار خوراک پتروشیمیایی یا منابع بیولوژیکی تولید می شود. استیک اسید رقیق تولید شده توسط تخمیر طبیعی، سرکه نامیده می شود.
باکتریهای مخمر سرکه به دلیل تمایل به تولید اسید استیک به این نام معروف شدهاند. این باکتریها در مواد غذایی، آب و خاک یافت میشوند. اسید استیک بطور طبیعی از میوهها و برخی مواد غذایی فاسد شده از فرایند تخمیر تولید میشوند و از قدیمیترین ترکیبات شیمیایی شناخته شده توسط انسان میباشد.
نامگذاری
نام «اسید استیک» رایجترین و رسمیترین نامی است که توسط IUPAC برای این ماده بکار میرود. این نام از کلمه لاتین acetum، به معنی سرکه، گرفته شدهاست. «اسید اتانوئیک» که به عنوان مترادف آن بکار میرود، یک نام سازمانیافتهاست که گاهی در معرفی نامگذاری مواد شیمیایی عنوان میشود.
«اسید استیک منجمد» یک نام سطحی برای اسید استیک بدون آب است. مثل نام آلمانی Eisessig(که به صورت تحتاللفظی به معنای سرکه یخی است)، این نام، از نام کریستالهایی برگرفته شده که در دمای اندکی زیر ۷/۱۶ درجه سانتیگراد(حدود ۶۲۲ درجه فارنهایت) شکل میگیرند.
رایجترین و رسمیترین نام اختصاری برای اسید استیک AcOH یا HOAc است که در آن Ac مخفف گروه عاملی|گروه استیل است CH۳−C(=O)−؛ در واکنشهای اسیدی، علامت اختصاری HAc بکار میرود که در آن Ac مخفف استات آنیون (CH۳COO−) میباشد، هر چند که بسیاری این نامگذاری را گمراه کننده میدانند. باید توجه داشت که در حالتی دیگر نباید Ac را با مخفف عنصر شیمیایی اکتینیم اشتباه گرفت.
فرمول ساده اسید استیک CH۲O و فرمولی مولکولی آن C۲H۴O۲ است. حالت آخر با هدف نشان دادن بهتر ساختار، بصورت CH۳-COOH, CH۳COOH، یا CH۳CO۲H نوشته میشود. یونی که در نتیجه حذف پروتون (H+) از اسید استیک به جا میماند «استات» آنیون نام دارد. همچنین نام «استات» به نمکی که حاوی این آنیون یا یک استر اسید استیک باشد اطلاق میگردد.
تاریخچه

اسید استیک منجمد
قدمت سرکه به اندازه عمر تمدن و حتی بیشتر است. اسید استیکهای باکتریزا در همه جای جهان وجود دارند و هر فرهنگی که در آن عملآوری خمر همچون آبجو یا شراب وجود داشته، به ناچار سرکه را نیز که نتیجه طبیعی تماس ایننوشیدنیهای الکلی با هوا بوده کشف کردهاند.
استفاده از اسید استیک در شیمی، به عهد باستان برمیگردد. در قرن سوم پیش از میلاد، تئوفراستوس فیلسوف یونانی|یونان تشریح کرد که سرکه چگونه بر روی فلزات اثر میکند تا از واکنش آنها رنگدانههای مورد استفاده در کارهای هنری تولید شوند که از آن جمله میتوان به «سرب سفید» (کربنات سرب) و «زنگار مس» اشاره کرد که ترکیبی سبز رنگ از نمکهای مس از جمله استات مس ۲ میباشد. رومیان باستان، شراب ترشیده را در ظرفهای سربی میجوشاندند تا از آن یک شربت بسیار شیرین با نام «ساپا» تهیه کنند. ساپا سرشار از استات سرب بود که به آن «شکر سرب» یا «شکر (افسانه)زحل میگفتند و اشراف روم آنرا در مسمومسازی با سرب بکار میگرفتند. در قرن هشتم، جابر بن حیان کیمیاگر ایرانی از طریق تقطیر اسید استیک را از سرکه جدا کرد.
در دوران رنسانس، اسید استیک منجمد از طریق تقطیر خشک استاتهای فلزی تهیه میشد. در قرن شانزدهم، آندریاس لیباویوس کیمیاگر آلمانی چنین رویهای را تشریح کرد و اسید استیک منجمد حاصل از این روش را با سرکه مقایسه کرد. وجود آب در سرکه بر ویژگیهای اسید استیک چنان تاثیر عمیقی داشت که شیمیدانها تا قرنها معتقد بودند که اسید استیک منجمد و اسیدی که در سرکه یافت میشود دو ماده مختلف هستند. پیر آدت شیمیدان فرانسوی ثابت کرد که این دو در حقیقت یکی هستند.
در سال ۱۸۴۷، هرمان کولب شیمیدان آلمانی برای اولین بار از طریق مواد معدنی موفق به ساخت اسید استیک شد. ترتیب این واکنش عبارت بود از کلردار کردن دی سولفید کربن و تبدیل آن به تترا کلراید کربن، سپس از طریق تفکافت به تتراکلورو اتیلن و از طریق کلردار کردن آبی به اسید تری کلرواستیک و در نهایت کاهش آن از طریق برقکافت به اسید استیک.
.[۲]

اسید استیک
تا سال ۱۹۱۰، اسید استیک منجمد اغلب از «تقطیر مشروبات الکلی» یا تقطیر چوب بدست میآمد. با استفاده از هیدروکسید کلسیم را جدا میکردند؛ سپس استات کلسیم به جا مانده را با استفاده از اسید سولفوریک اسیدی میکردند تا از آن اسید استیک بدست آید. در همین زمان، آلمان ۱۰٫۰۰۰ تن اسید استیک منجمد تولید میکرد که ۳۰درصد از آن برای تولید رنگ نیل استفاده میشد.[۳][۴]
خواص شیمیایی
؛ قدرت اسیدی اتم هیدروژن (H) در گروه کربوکسیل (−COOH) در اسیدهای کربوکسیلیک همچون اسید استیک، میتواند به عنوان یک یون (پروتون) H+ آزاد شود و به آنها خاصیت اسیدی دهد. اسید استیک در محلولهای آبی یک اسید تکپروتونی مؤثر است با ارزش ثابت تفکیک اسیدی(pKa) آن   ۰/ ۱ A ۸/۴; pH مولاریته محلول آن (در حدود انسجام سرکه خانگی) ۴/۲ است که نشان میدهد ۴/۰ درصد از مولکولهای اسید استیک تفکیک یافتهاند.

دی مر چرخهای اسید استیک؛ خطوط تیره نشاندهنده پیوندهای هیدروژنی هستند
ساختار کریستالی اسید استیک [۵] نشان میدهد که مولکولها به صورت دی مر جفت میشوند که پیوندهای هیدروژنی آنها را به هم متصل کردهاست. دی مرها را میتوان در بخار ۱۲۰درجه سانتی گراد شناسایی کرد. این حالت ممکن است در فاز مایع اسید استیک خالص نیز رخ دهد اما در صورت وجود آب، به سرعت به هم میریزد. سایر اسیدهای کربوکسیلیک پایینتر نیز این رفتار دیمرسازی را دارند.
حلال
اسید استیک مایع، مانند آب و اتانول یک حلال پروتوندار آبدوست (مولکول قطبی|قطبی) است. این ماده با ثابت دی الکتریک ۲/۶، میتواند علاوه بر حل کردن ترکیبات قطبی همچون نمکهای معدنی و شکرها، ترکیبات غیر قطبی همچون روغنها وعناصر شیمیایی مثل سولفور و آیودین را در خود حل کند. این ماده با بسیاری از حلالهای قطبی و غیر قطبی همچون آب، کلروفورم و هگزان مخلوط میشود. این خاصیت انحلال و امتزاجپذیری اسید استیک آنرا به یک ماده شیمیایی پرکاربرد صنعتی تبدیل کردهاست.
واکنشهای شیمیایی
اسید استیک برای بسیاری از فلزات از جمله آهن، منیزیم و روی خاصیت خورندگی دارد و در واکنش با آنها، گاز هیدروژن و نمکهای فلزی به نام استاتها تولید میکند. با قرار گرفتن آلومینیوم در معرض اکسیژن، یک لایه نازک از اکسید آلومینیوم بر روی سطح آن ایجاد میشود که نسبتاً مقاوم است. در نتیجه تانکرهای آلومینیومی در حملونقل اسید استیک مورد استفاده قرار میگیرند. استاتهای فلزی را میتوان از واکنش اسید استیک با یک باز نیز بدست آورد؛ که نمونه مشهور آن واکنش « جوش شیرین = سرکه» میباشد. به جز استات کرومیم ۲۲، تقریباً کلیه استاتها در آب قابل حل هستند.

واکنشهای شیمیایی عادی یک اسد کربوکسیلیک در مورد اسید استیک اتفاق میافتد که تشکیل اتانول از طریق کاهش و تشکیل مشتقاتی همچون کلرید استیل از طریق استخلاف هستهدوست اسیل، از موارد قابل توجه آن هستند. دیگر مشتقات استخلافی عبارتند از آنیدریدهای استیک؛ این آنیدرید از طریق از دست دادن آب در دو مولکول اسید استیک رخ میدهد. به همین ترتیب، استرهای اسید استیک میتوانند از طریق استری کردن فیشری تشکیل شوند و آمیدها نیز به همین ترتیب بوجود آیند. در صورتیکه اسید استیک در معرض حرارت بالای ۴۴۰ درجه سانتیگراد قرار گیرد، تجزیه شده و از آن دی اکسید کربن و متان یا کتن و آب تولید میشود.
شناسایی
اسید استیک را میتوان از طریق بوی خاص آن شناخت. یک واکنش رنگی برای نمکهای اسید استیک محلول کلرید آهن ۳ است که رنگ قرمز سیر ایجاد میکند که پس از اسیدیسازی ناپدید میشود استاتها وقتی با تری اکسید آرسنیک از اکسید کاکودیل حرارت داده میشوند، از طریق بوی بدی که تولید میکنند قابل شناسایی هستند.
بیوشیمی
گروه عامل|گروه استیل، که از اسید استیک مشتق شدهاند تقریباً در بیوشیمی کلیه گونههای حیات نقشی بنیادین دارند. آنها در مجاورت با کوآنزیم A به مهمترین قسمت متابولیسم کربوهیدراتها و چربیها تبدیل میشوند. در عین حال، به خاطر جلوگیری از برهم خوردن کنترل pH محتویات سلولی، تجمع اسید استیکهای آزاد در سلولها در سطوح پایین حفظ میشود. برخلاف اسیدهای کربوکسیلیک با زنجیره بلندتر(اسیدهای چرب)، اسید استیک در تری گلیسریدهای طبیعی بوجود نمیآید. در عین حال، تری گلیسیرید مصنوعی تری استین (گلیسیرین تری استات) یک افزودنی غذایی متداول است و در مواد آرایشی و داروهای موضعی بکار گرفته میشوند.
اسید استیک توسط برخی میکروبهای گیاهی تولید و دفع|مدفوع میشوند که از مهمترین آنها میتوان به دسته «بچه سرکه» و کلوستریدیم استو بیتی لیکیوم اشاره کرد. این باکتریها در همه جا در مواد غذایی، آب و خاک یافت میشوند و با گندیدن میوهها و سایر غذاها، اسید استیک بطور طبیعی تولید میشود. اسید استیک همچنین یکی از ترکیبات لیزکننده مهبلی آدمیزاد و سایر پستانداران نخستی است و در آنجا به عنوان یک عامل ضد باکتری ملایم عمل میکند.[۶]
تولید
کارخانه تصفیه و تغلیظ اسید استیک در سال 1884
اسید استیک، هم بطور مصنوعی و هم از طریق تخمیر باکتریایی، تولید میشود. امروزه روش باکتریایی تنها ۱۰ درصد از تولید را به خود اختصاص دادهاست اما به دلیل اینکه قوانین جهانی مربوط به سلامت غذا بر تهیه سرکه خوراکی از مواد بیولوژیکی تاکید میکند، این روش همچنان برای تولید سرکه استفاده میشود. تقریباً حدود ۷۵ درصد از اسید استیک تولید شده برای استفادههای صنعتی، از کربندار کردن متانول و به روشی که در زیر میآید تولید میشود. برای بقیه مصارف، از روشهای دیگر استفاده میشود.[۷]
کل تولید جهانی اسید استیک   ۵ میلیون تن در سال برآورد میشود که نیمی از آن در ایالات متحده تولید میشود. تولید این ماده در اروپا ۱ میلیون تن در سال است که میزان آن رو به کاهش نهاده؛ در ژاپن نیز تولید این ماده ۷/۰ میلیون تن در سال است. از سوی دیگر هرسالانه ۵/۱ میلیون تن اسید استیک بازیافت میشود که تولید جهانی را به ۵/۶ میلیون تن در سال میرساند.[۸][۹]
بزرگترین تولیدکنندگان اسید استیک دست نخورده، سلانس و بیپی|صنایع شیمیایی بی پی هستند. از دیگر تولیدکنندگان عمده این ماده میتوان به ملنیوم کمیکالز، استرلینگ کمیکالز، سام سونگ، ایستمن و سوونسک اتانول کمی اشاره کرد.
روشهای تولید صنعتی اسید اسیتیک
کربونیلاسیون متانول : در این روش متانول با مونوکسید کربن در فشارهای بالا (۲۰۰atm) واکنش داده و اسید استیک تولید میکند. این روش از سال ۱۹۲۰ ابداع شدهاست و به دلیل ارزان بودن متانول و از لحاظ اقتصادی مقرون به صرفهاست.
اکسیداسیون بوتان : از حرارت دادن بوتان با اکسیژن هوا در حضور یونهای فلزی منگنز، کبالت و کروم، پروکسید تولید میشود. پروکسید در اثر تجزیه اسید استیک ایجاد میکند.
{۲C_۴HiO + CO_۲ → ۴CH_۳COOH + ۲H_۲O}
اکسیداسیون استالدئید : استالدئید در شرایط ملایم و در حضور کاتالیزورهای ساده فلزی مثل منگنز و کروم و... توسط اکسیژن هوا اکسید شده و اسید استیک تولید میکند.
{۲CH_۳CHO + ۲O_۲ → ۲CH_۳COOH}
محصولات جانبی تولید شده در این واکنش مانند اسید فرمیک یا استات اتیل و... به دلیل داشتن نقطه جوش پایینتر از اسید استیک توسط تقطیر جداسازی میشوند. کاربرد اسید استیک به صورت سرکه به عنوان چاشنی غذا و تهیه انواع ترشی استفاده میشود. اسید استیک رقیق به عنوان افشانه برای از بین بردن قارچهای گیاهان استفاده میشود. اسید استیک گلاسیال در صنایع شیمیایی در تولید فیلمهای عکاسی، تولید پلاستیک پلیاتیلن تریفتالات (PETT) استفاده میشود. همچنین به عنوان ماده واسطه در تولید استات وینیل که ترکیب مهمی در تولید چسب و رنگ میباشد،
کربندارکردن متانول
بیشتر اسید استیک جهان به روش کربندار کردن متانول تولید میشود. در این فرایند، متانول و مونو اکسید کربن با یکدیگر واکنش میدهند تا بر اساس معدله شیمیایی زیر اسید استیک تولید شود:
متانول|CH۳OH+مونواکسید کربن |CO→ CH۳COOH
این فرایند که در آن یودو متان به عنوان میانجی مورد استفاده قرار میگیرد، در سه مرحله اتفاق میافتد. یک کاتالیزور که عمدتاً یک کمپلکس است برای کربندار کردن مورد استفاده نیاز است. (گام ۲)
(۱)CH۳OH+ یودید هیدروژن|HI→یودومتان|CH۳I + H۲O
(۲) CH۳I + مونواکسیدکربن |CO → CH۳COI
(۳) CH۳COI + H۲O → CH۳COOH + HI
با تغییر شرایط فرایند، میتوان در همان کارخانه آنیدرید استیک تولید کرد. از آنجاکه هم متانول و هم مونواکسیدکربن مواد خام مناسبی هستند، کربندارکردن متانول از درباز به عنوان یکی از بهترین روشها برای تولید اسید استیک به شمار میآمدهاست. در سال ۱۹۲۵، هنری درفیوس از سلانس بریتانیا یک کارخانه موازی کربندارکردن متانول را تاسیس کرد.[۱۰] با این حال نبود مواد کاربردی که بتوانند در فشارهای بالای مورد نیاز (۲۰۰۰ (واحد)اتمسفر یا بیشتر) حاوی مخلوطهای واکنشی خورنده باشند، باعث شد برای مدتی تمایل به تجاریسازی این روشها از بین برود.
اولین فرایند تجاری کربندارکردن متانول که در آن از کوبالت به عنوان کاتالیزور استفاده میشد، در سال ۱۹۶۳ توسط شرکت صنایع شیمیایی BASF انجام گرفت. در سال ۱۹۶۸، یک کاتالیزور رودیومی (cis−[Rh(CO)۲I۲]−) که میتوانست در فشارهای پایین بدون تولید هیچ فراورده جانبی عمل کند کشف شد. اولین کارخانهای که از این روش استفاده کرد، در سال ۱۹۷۰ توسط شرکت صنایع شیمیایی مونسانتو آمریکا ساخته شد و از آن پس، کربندارکردن متانول با کاتالیزور رودیومی به روش غالب در تولید اسید استیک تبدیل شد. (همچنین رجوع کنید به فرایند مونساتو). در اواخر دهه نود، شرکت صنایع شیمیایی بیپی استفاده تجاری از کاتالیزور کاتیوا ([Ir(CO)۲I۲]−) را که بوسیله روتنیم ارتقا یافته بود آغاز کرد. این فرایند که کاتالیزور آن ایریدیوم است طبیعتدوستتر و کارآمدتر است[۱۱] و تا حد زیادی جای فرایند مونسانتو را در همان کارخانه گرفتهاست.
اکسایش استالدئید
پیش از تجاری شدن روش مونسانتو، بیشتر اسید استیک از طریق اکسایش استالدئید تولید میشد. این روش به عنوان دومین روش مهم تولید پابرجا ماندهاست، هر چند که کربندارکردن متانول در آن، چندان مقرون به صرفه نیست. استالدئید را میتوان از طریق اکسایش بوتان یا نفتا یا آبدار کردن اتیلن بدست آورد.
وقتی بوتان یا نفتای سبک در مجاورت یونهای مختلف فلزی از جمله یونهای منگنز، کوبالت، کرومیوم، پروکسید حرارت میبینند تجزیه میشوند تا براساس معادله شیمیایی زیر اسید استیک تولید کنند.
۲ بوتان|C۴H۱۰ + ۵ اکسیژن|O۲ → ۴ CH۳COOH + ۲ آب|H۲O
معمولاً، این واکنش در تلفیقی از حرارت و فشاری انجام میشود که در عین نگهداری بوتان در حالت مایع، دما را تا حد ممکن بالا نگه دارد. شرایط واکنشی معمولاً در دمای ۱۵۰ درجه سانتیگراد و فشار  ؛ اتمسفر ۵۵ قرار دارد. ممکن است در این میان چند فراورده جانبی نیز تولید شوند از جمله بوتانون، استات اتیل، اسید فورمیک و اسید پروپونیک. این فراوردههای جانبی از لحاظ تجاری با ارزش هستند و در صورتیکه از لحاظ اقتصادی مورد نیاز باشند، شرایط واکنش را تغییر می.دهند تا مقادیر بیشتری از این فراوردهها بدست آید. در عین حال جداسازی اسید استیک از این فراوردههای جانبی ممکن است هزینههای فرایند را افزایش دهد.
تحت شرایط مشابه و با استفاده از کاتالیزورهای یکسان، همانگونه که در اکسایش بوتان صورت میگیرد، میتوان در هوا، استالدئید را برای تولید اسید استیک، توسط اکسیژن اکسید کرد.
۲ استالدئید|CH۳CHO + اکسیژن|O۲ → ۲ CH۳COOH
با استفاده از کاتالیزورهای جدید، میتوان از این واکنش بیش از ۹۵ درصد اسید استیک بدست آورد. فراوردههای جانبی این واکنش عبارتند از استات اتیل، اسید فورمیک و فورمالدئید که همه آنها نسبت به اسید استیک نقطه جوش پایینتری داشته و به راحتی میتوان از طریق تقطیر آنها را جداسازی کرد.
اکسایش اتیلن
تخمیر
؛ تخمیر اکسایشی
در بیشتر تاریخ بشری، اسید استیک در حالت سرکه، توسط گروه باکتریایی «بچه سرکه» ساخته میشدهاست. درصورت وجود اکسیژن کافی، این باکتری میتواند از انواع مختلف مواد غذایی الکلدار، سرکه تولید کند. شاخصترین این غذاها عبارتند از آب سیب، شراب و مخمر غلات|حبوبات، مالت، برنج، یا مالت سیبزمینی. کلیت واکنش شیمیاییای که توسط این باکتری تسهیل میشود عبارتست از
اتانول|C۲H۵OH + اکسیژن|O۲ → CH۳COOH + آب|H۲O
محلول رقیق الکل که با «مخمر سرکه» آغشته شده باشد، در یک محیط گرم هوادار، طی چند ماه به سرکه تبدیل میشود. روشهای صنعتی تولید سرکه، با افزایش تامین اکسیژن برای باکتری، این فرایند را تسریع میکنند.
احتمالاً اولین سرکهها، در پی اشتباه در فرایند شرابگیری تولید شدهاند. اگر فراین تخمیر در حرارت بالا انجام گیرد، بچه سرکه بطور طبیعی مخمر انگور را میپوشاند. با افزایش تقاضای سرکه برای مصارف آشپزی، پزشکی و بهداشتی، شرابفروشان خیلی سریع یاد گرفتند تا چگونه در ماههای گرم پیش از آنکه انگورها برای تبدیل به شراب به اندازه کافی برسند، سایر مواد آلی را برای تولید سرکه مورد استفاده قرار دهند. از آنجا که شرابفروشان از چگونگی این فرایند آگاهی لازم را نداشتند، این روش کند و گاهی ناموفق بود.
یکی از اولین روشهای مدرن «روش سریع» یا «روش آلمانی» است که برای اولین بار در سال ۱۸۲۳ در آلمان بکار گرفته شد. در این فرایند، تخمیر در یک برج بستهبندی شده با تراشههای چوب یا زغال چوب صورت میگیرد. غذای الکلدار از بالای برج پاشیده میشود و اتمسفر زمین|هوای تازه یا بطور طبیعی یا بصورت تبادل حرارت اجباری از پایین تامین میشود. در این فرایند، تامین بهتر هوا، زمان تهیه سرکه را از چند ماه به چند هفته کاهش میدهد.
امروزه بیشتر سرکهها در تانکرهای کشت میکروبیولوژیکی|کشت که در زیر آب غوطهور هستند تهیه میشوند. این روش برای اولین بار در سال ۱۹۴۹ توسط اوتو هروماتکا و هنریخ ابنر ابداع شد. در این روش، الکل در یک تانکر که بطور مداوم محتویات آن به هم میخورد، به سرکه تخمیر میشود و اکسیژن نیز از طریق عبور حبابهای هوا از درون محلول تامین میشود.
؛ تخمیر بدون اکسیژن
برخی گونههای باکتریهای بیهوازی از جمله چندین نوع از دسته «کلاستریدیوم» قادرند بطور مستقیم و بدون استفاده از اتانول به عنوان میانجی، شکرها را به اسید استیک تبدیل کنند. کلیت واکنش شیمیایی که توسط این باکتری انجام میشود عبارتست از:
گلوکوز|C۶H۱۲O۶ → ۳ CH۳COOH
جالبتر اینکه، از نظر شیمیدانان صنعتی، این باکتریهای بیهوازی| بیهوازیها میتوانند اسید استیک را از ترکیبات تک کربنی نظیر متانول، مونواکسیدکربن یا مخلوط دیاکسید کربن و هیدروژن تولید کنند:
۲دیاکسید کربن |CO۲+۴هیدروژن|H۲→ CH۳COOH + ۲ آب|H۲O
توانایی «کلوستریدیوم» در بهکارگیری مستقیم شکر، یا تولید اسید استیک از مواد کم هزینهتر بدین معناست که این نوع از باکتری بطور بالقوه میتواند نسبت به اکسایندگان اتانول نظیر «بچه سرکه»، در تولید اسید استیک کارآمدتر باشد. با این حال، باکتری «کلاستریدیوم» نسبت به «بچه سرکه» در مقابل اسید مقاومت کمتری دارد. حتی در مقایسه با برخی انواع بچه سرکه که میتوانند با غلط ۲۰ درصدی اسید استیک سرکه تولید کنند، مقاومترین انواع «کلاستریدیوم» تنها میتوانند چند درصد اسید استیک در سرکه تولید کنند. در حال حاضر برای تولید سرکه، استفاده از «بچه سرکه» نسبت به استفاده از «کلاستریدیوم» و سپس تغلیظ آن، مقرون به صرفهتر است. در نتیجه با وجودی که باکتریهای استوژنیک از سال ۱۹۴۰ کشف شدهاند استفاده صنعتی از آنها به تعدادی کاربرد بی خطر محدود شدهاست.
کاربردها

بطری 5/2 لیتری اسید استیک در آزمایشگاه
تولید بسیاری از بسیاری از ترکیبات شیمیایی، اسید استیک به عنوان یک واکنشگر شیمیایی به کار میآید. مهمترین کاربرد خاص اسید استیک در تولید استات وینیل تکپاره است، که بلافاصله پس از آن آنیدرید استیک و استر تولید میشود. میزان اسید استیک مورد استفاده در سرکه به نسبت اندک است.
استات وینیل تکپاره
کاربرد اصلی اسید استیک در تولید استات وینیل تکپاره (VAM) است. بین ۴۰ تا ۴۵ درصد از اسید استیک تولید شده در جهان، به مصرف این کاربرد میرسد. این واکنش که کاتالیزور آن پالادیوم است، اتیلن، اسید استیک و اکسیژن تولید میکند.
۲ H۳C-COOH + ۲ اتیلن|C۲H۴ + اکسیژن|O۲ → ۲ استات وینیل |H۳C-CO-O-CH=CH۲ + ۲ آب (مولکول)|H۲O
استات وینیل میتواند به استات پلی وینیل یا سایر پولیمرها، پولیمریزه شود که این مواد در رنگها و چسبها کاربرد دارند.
تولید استر
مهمترین استرهای اسید استیک در تولید جوهر و رنگ و پوشش استفاده می شوند. استرها شامل انیل استات و نرمال بوتیل استات و ایزو بوتیل استات و پروپیل استات می شوند. آنها معمولاً توسط واکنش کاتالیستی ار اسید استیک و الکل تولید می شوند.
بیشتر استرهای استات، از استالدهید با استفاده از واکنش تیشچنکو تولید می شود. علاوه بر این، استات ها اتر به عنوان حلال برای نیترو سلولز، لاک اکریلیک، لاک الکل زدن به جداکننده ها و لکه های چوب استفاده می شود. اول، مونومرهای گلیکول از اتیلن اکسید یا اکسید پروپیلن با الکل تولید می شوند، که سپس با اسید استیک استری می گردند. سه محصول عمده عبارتند از اتیلن گلیکول اتر استات (EEA)، اتیلن گلیکول مونو بوتیل اتر استات (EBA)، و پروپیلن گلیکول مونو متیل اتر استات، معمولتر به عنوان PGMEA در فرایند تولید نیمه هادی، جایی که آن را به عنوان مقاومت در برابر حلال مورد استفاده شناخته شده است . این مصرف حدود 15 ٪ تا 20 ٪ از اسید استیک در سراسر جهان را شامل می شود. اتر استات ها به عنوان مثال EEA، نشان داده شده است به عنوان عوامل مضر برای تولید مثل انسان است.
آنیدرید استیک
محصول مایعسازی دو مولکول اسید استیکآنیدرید استیک است. تولید جهانی آنیدرید استیک اصلیترین کاربرد است که بین ۲۰ تا ۳۰ درصد از تولید اسید استیک در جهان را به مصرف خود میرساند. آنیدرید استیک را میتوان بطور مستقیم از #کربندار کردن متانول|کربندار کردن متانول در مجاورت اسید تولید کرد و میتوان کارخانههای کاتیوا| فرایند کاتیوا را برای تولید آنیدرید تطبیق داد.
آنیدرید استیک، یک عامل قوی اسیددار کردن است. با داشتن چنین خاصیتی، کاربرد اصلی آن در تولید [ترموپلاستیک سلولزی است که به عنوان یک بافت مصنوعی در فیلم عکاسی بکار میرود. همچنین آنیدرید اسید در تولید آسپرین، هرویین و سایر ترکیبات به عنوان واکنشگر عمل میکند.
سرکه
نوشتار اصلی: سرکه
در حالت سرکه و نیز در نمکسود کردن سایر سبزیجات، محلولهای اسید استیکی (معمولاً ۵ تا ۱۸ درصد اسید استیک، با درصدی که معمولاً بر حسب جرم محاسبه میشود) بطور مستقیم به عنوان یک چاشنی مورد استفاده قرار میگیرند. سرکه خانگی اغلب رقیقتر است (۵ تا ۸ درصد اسید استیک)، ولی در نمکسود کردن غذاها برای مصارف تجاری، محلولهای غلیظ تری مورد استفاده قرار میگیرد. میزان اسید استیکی که در سطح جهانی برای تولید سرکه مورد استفاده قرار میگیرد زیاد نیست اما از دیر باز این ماده یکی از پر کاربردترین مواد در تولید سرکه بودهاست.
کاربرد به عنوان حلال
همانگونه که گفته شد اسید استیک# خواص شیمیایی|بالا، اسید استیک منجمد یک حلال پروتوندار قطبی بسیار عالی است. این ماده اغلب در تصفیه مواد آلی به عنوان حلال کریستالسازی مجدد بکار میرود. اسید استیک ذوب شده خالص در تولید اسید ترفتالیک که ماده خام پلی اتیلنترفتالیک (PET)است، به عنوان حلال بکار میرود. اگر چه در حال حاضر این کاربرد ۵ تا ۱۰ درصد از اسید استیک تولید شده در جهان را مصرف میکند، با افزایش تولید PETT انتظار میرود این کاربرد افزایش بیشتری پیدا کند.
در واکنشهایی همچون فریدل کرافتس# اکلیلدار کردن فریدل کرافتس| اکلیلدار کردن فریدل کرافتس که در آنها کربوکاتیون وجود دارد، اسید استیک به عنوان یک حلال بکار میرود. به عنوان مثال، یک مرحله از تولید تجاری کافور مصنوعی، شامل نوآرایی ونگر میروین کمفین به استات ایزوبورنیل است؛ در این حالت اسید استیک برای حفظ کربندار کردن واکنش نوآرایی|بازآراسته، هم به عنوان حلال و هم به عنوان یک هسته دوست عمل میکند. در هنگام کاهش|اکسایش یک گروه نیترو آریل به یک آنیلین با استفاده از پالادیوم کربنی، اسید استیک به عنوان حلال انتخابی استفاده میشود.
در شیمی تحلیلی، اسید استیک منجمد برای تخمین مواد قلیایی ضعیف همچون آمیدهای آلی بکار میرود. اسید استیک منجمد به عنوان باز (شیمی)| باز از آب هم ضعیفتر است در نتیجه در این میانجی، آمید به عنوان یک باز قوی عمل میکند. سپس با استفاده از یک محلول در اسید استیک منجمد با خاصیت اسیدی بسیار قوی همچون اسید پرکلورید، میتوان عیار آنرا اندازه گرفت.
سایر کاربردها
محلولهای رقیق اسید استیک، همچنین به خاطر خاصیت اسیدی ملایم آنها، مورد استفاده قرار میگیرند. در محیط خانگی، استفاده در آبگونه اسیدی ظهور فیلم و برداشتن جرم شیرآب و کتری از نمونههای آن است. خاصیت اسیدی همچنین از طریق سلولهای نیش ستاره دریایی، در درمان نیشستاره دریایی جعبهای استفاده میشود که این کار از آسیبهای جدی و یا حتی مرگ جلوگیری میکند. این خاصیت همچنین در درمان افراد مبتلا به آماس گوش| عفونت گوش خارجی به کار می.رود. همچنین در سیلوی خوراک دام، برای جلوگیری از رشد باکتریها و قارچها، بصورت افشانه از اسید استیک استفاده میشود. محلولهای رقیق اسید استیک می تواند در آزمایشگاه بالینی برای تشخیص تعداد گلبولهای قرمز و سفید استفاده شوند. یکی دیگر از استفاده های بالینی برای lysingg سلول های قرمز خون است، که می تواند ترکیبات مهم دیگر در ادرار را در هنگام آزمایش میکروسکوپی شناسایی کند. اسیدیته آن همچنین برای درمان نیش عروس دریایی کاربرد دارد و اگر فوراً استفاده شود از جراحات حاد و حتی مرگ جلو گیری می کند. و برای درمان عفونت گوش خارجی استفاده می شود. در این روش، اسید استیک به صورت افشانه بر برای علوفه دام به عنوان نگهدارنده افشانده می شود، تا رشد باکتری و قارچ تضعیف شود. اسید استیک آبی همچنین به عنوان یک حذف کننده زگیل و گندمه استفاده می شود از اسید استیک چندین نمک آلی و غیر آلی تولید میشود، از جمله:
استات سدیم__ در صنعت نساجی و نیز به عنوان نگهدارنده غذایی (E number|E۲۶۲).
استات مس ۲__ به عنوان رنگدانه و قراچکش
استات آلومینیوم و استات آهن ۲__ به عنوان ثابتکننده رنگ
استات پلادیوم ۲__ به عنوان کاتالیزور در واکنشهای جفتساز، همچون واکنش هک
استات نقره در حشره کشها
کنترل و از بین بردن کنه واروا در زنبور عسل
اسید استیکهای جایگزین تولید شده عبارتند از:
اسید مونوکلرواستیک. MCA، اسید دیکلرو استیک (به عنوان محصول فرعی) و تری کلرواستیک. MCA در تولید رنگ نیل استفاده میشود.
اسید برومو استیک، که برای تولید واکنشگر برومو استات اتیل استری میشود.
اسید تری فلوئورواستیک که در ترکیبات عالی، یک واکنشگر رایج است.
مقادیر اسید استیکی که در سایر کاربردها بکار میرود (بجز TPA)، ۵ تا ۱۰ درصد از اسید استیک مورد استفاده درسطح جهان را به خود اختصاص دادهاست. در عین حال، انتظار نمیرود این کاربردها به اندازه تولیدTPA، رشد کند.
ایمنی
اسید استیک غلیظ خورندهاست و در نتیجه باید با احتیاط با آن کار کرد، زیرا باعث سوختگی، آسیبهای دائم چشمی و سوزش اعضای دارای مایعات مخاطی میشود. این تاولها و آبلهها ممکن است تا چند ساعت پس از در معرض قرار گرفتن پدیدار نشوند. به هنگام کار کردن با این ترکیبها باید از دستکشهای مقاوم از جنس پلاستیک نیتریل استفاده کرد چراکه استفاده از دستکشهای لاتکس از ایمنی لازم برخوردار نیست. اسید استیک غلیظ در شرایط آزمایشگاهی به سختی مشتعل میشود. با بالا رفتن دما از مرز ۳۹ درجه سانتیگراد، ریسک تبدیل شدن آن به یک ماده منفجره در مجاورت هوا افزایش مییابد. (حد انفجار: ۴/۵ درصد تا ۱۶۶ درصد).
خطر محلولهای اسید استیک به میزان غلظت آن بستگی دارد. محلولهایی که اسید استیک آنها بیش از ۲۵ درصد است، به خاطر بوی زننده و بخار خورنده آنها در هود بخار نگهداری میشود. اسید استیک رقیق به شکل سرکه بی ضرر است. با اینحال وارد کردن محلولهای قویتر در آن، برای انسان و حیوانات ضرر دارد. این محلول به سیستم گوارش آسیب زده و تغییری مهلک را در خاصیت اسیدی خون ایجاد میکند.
به دلیل عدم تطبیق آن، پیشنهاد می شود که اسید استیک را از اسید کرومیک و اتیلن گلایکول و اسید نیتریک و اسید پر کلریک و پرمنگنات ها و پر اکسید ها و هیدروکسیل ها دور نگه دارید.
جستارهای وابسته
سرکه
نمکسود کردن، روشی برای نگهداری غذا
باکتری اسید استیک، تولید سرکه از محلولهای الکلی
اسید استیک (صفحه دادهها)
بچه سرکه، یک دسته مهم از باکتریهای اسید استیک
عامل پوستهزدایی، اغلب حاوی اسید استیک
؛ شیمی
مواد شیمیایی معمولی، محل خرید مواد شیمیایی مورد استفاده در آزمایشها
اسید کربوکسیلیک، هستند-COOH ترکیباتی که حاوی گروه
اسید چرب، زنجیره مستقیم اسید کربوکسیلیک * استات آنیون، CH۳COO−، بطر خلاصه ‘’AcO−’’
گروه استیل، گروه CH۳-CO–، بطور خلاصهAc
کوآنزیم استیلA، یک حامل مهم استیل در سلولها
؛ مواد شیمیایی مرتبط
اسید فورمیک، اسید کربوکسیلیک با یک اتم کربن کمتر به ازای هر مولکول
اسید پروپیونیک، اسید کربوکسیلیک با یک اتم کربن بیشتر به ازای هر مولکول
اتانول، اتیل الکل
استالدئید
استیک آنیدرید
استات اتیل، یک حلال مهم
اسید مونو کلرو استیک
اسیدهای کلرواستیک
سولفوریک اسید: مشخصات
سولفوریک اسید که در گذشته با نام جوهر گوگرد خوانده میشد، اسیدی بسیار قوی است که با هر درصدی در آب حل میشود و فرمول شیمیایی آن H۲SO۴ است. پی اچ(pH) این اسید ۰/۵ (۵۵ دهم) میباشد.
سولفوریک اسید برای نخستین بار توسط جابر بن حیان کشف شد.[۱] او با تقطیر کانیهای سولفات آهن (معروف به زاج سبز) (آهن سولفات هفت آبه به فرمول FeSO4.7H2O) و مس(II) سولفات، این اسید را به دست آورد.
از سولفوریک اسید در مواد شوینده، رنگ نقاشی و غیره استفاده میشود.
محتویات
[نهفتن]
۱خواص فیزیکی
۲ساختار مولکولی و خصلت اسیدی
۳تولید سولفوریک اسید
۳.۱فرایند مجاورت[۳]
۳.۲دیگر روشها
۴منابع
۵پیوند به بیرون
1- خواص فیزیکی
این ماده دارای مولکولهای دارای گشتاور قطبی است که میتوانند با یکدیگر پیوند هیدروژنی برقرار کنند. پس سولفوریک اسید مایعی است با نقطه جوش بالا و هم چنین یک مایع ویسکوز (دارای گران روی زیاد) محسوب میشود. همین شرایط مولکولی باعث میشوند که سولفوریک اسید به خوبی در آب حل شود و محلولهای اسیدی مختلف تولید کند.
2- ساختار مولکولی و خصلت اسیدی
این ماده از مولکولهایی شامل یک اتم گوگرد، چهار اتم اکسیژن و دو اتم هیدروژن ساخته شده است. از آنجا که هیدروژنها به اتم اکسیژن متصل هستند، حامل بار مثبت جزیی میباشند و قادرند به عنوان هیدروژن اسیدی عمل کنند. با از دست دادن اولین هیدروژن، آنیون هیدروژنسولفات تولید میشود که با توجه به ساختارهای رزونانسی، بسیار پایدار است؛ بنابراین اولین تفکیک سولفوریک اسید، به شکل کامل انجام میشود:
H2SO4 + H2O → HSO4- + H3O+ (1
برای دومین مرحله، باید هیدروژن به شکل کاتیون، آنیون هیدروژنسولفات را ترک کند که چندان راحت نیست؛ بنابراین تفکیک دومین هیدروژن اسیدی در سولفوریک اسید، کامل نیست و یکواکنش تعادلی است:[۲]
HSO4- + H2O ⇔ H3O+ + SO42- (2
3- تولید سولفوریک اسید
3-1: فرایند مجاورت
سولفوریک اسید، یکی از مهمترین مواد شیمیایی صنعتی است که با استفاده از فرایند مجاورت تولید میشود. در مرحله نخست گوگرد در مجاورت اکسیژن ، اکسید شده و گوگرد دیاکسید به دست میآید:
S(s) + O2(g) → SO2(g) (1
در مرحله بعد گوگرد دی اکسید در مجاورت یک کاتالیزگر و در واکنش با اکسیژن اضافی به SO۳ اکسیده میشود:
SO2(g) + O2(g) → SO3(g) (2
این واکنش گرماده است و انتروپی(بی نظمی ) آن کاهش می یابد چون عامل انتروپی نامساعد است (پدیده های جهان به سمت بی نظمی بیشتر می روند) یک عامل نامساعد ترمودینامیکی دارد پس برگشت پذیر است
واکنش بالا در دمای معمولی بسیار کند است؛ لذا در روش صنعتی، از دماهای بالاتر (۴۰۰C تا۷۰۰C) و از یک کاتالیزور (مانند وانادیم پنتوکسید V۲O۵ یا اسفنج پلاتین) استفاده میشود. از واکنش گوگرد تری اکسید با آب، محلول سولفوریک اسید تشکیل میشود:
SO3(g) + H2O(l) → H2SO4(aq) (3
با تکرار مراحل بالا و دمیدن گوگرد تریاکسید درون محلول سولفوریک اسید، پیروسولفوریک اسید (H2S2O7) تشکیل میشود:
H2SO4(l) + SO3(g) → H2S2O7(l) (4
سپس با افزودن آب به پیروسولفوریک اسید، محلول سولفوریک اسید را تهیه میکنند:
H2S2O7(l) + H2O(l) → 2H2SO4(l) (۵
کنترل این روش که در آن، پیروسولفوریک اسید تشکیل میشود، آسان تر از واکنش مستقیم گوگرد تری اکسید با آب است؛ بنابراین از این واکنش برای تولید سولفوریک اسید با درصد معین و غلظت دلخواه استفاده میکنند.
3-2: دیگر روشها
سولفوریک اسید را میتوان در آزمایشگاه از واکنش گاز گوگرد دی اکسید با هیدروژن پراکسید (آب اکسیژنه) به دست آورد.
(g) + H۲O2 (l) → H۲SO۴ (l)SO2
روش دیگر تولید سولفوریک اسید در آزمایشگاه با استفاده از الکترولیز محلول مس (ll) میباشد که کاتد باید از فلزی باشد که رسانایی خوبی دارد، مانند مس وآند نیز باید از جنس پلاتین یا زغال باشد تا با محلول واکنش ندهد
| سولفوریک اسید | |||
|---|---|---|---|
|
|||
| شناساگرها | |||
| شماره ثبت سیایاس | ۷۶۶۴-۹۳-۹ | ||
| شمارهٔ آرتیئیسیاس | WS5600000 | ||
| خصوصیات | |||
| فرمول مولکولی | H2SO4 | ||
| جرم مولی | 98/078 g/mol | ||
| شکل ظاهری | مایع شفاف، بیرنگ و بیبو | ||
| چگالی | 1.84 g cm−3 liquid | ||
| دمای ذوب | 10°C | ||
| دمای جوش |
290°C bp of pure acid. 98% solution boils at 338 °C
|
||
| انحلالپذیری درآب | حلپذیری کامل (گرماده) انتالپی منفی | ||
| گرانروی | 26.7 cP at 20 °C | ||
| خطرات | |||
| طبقهبندی ئییو | |||
| کدهای ایمنی | R۳۵ | ||
| شمارههای نگهداری | (S1/2), S26, S۳۰, S45 | ||
| لوزی آتش |
 |
||
| نقطه اشتعال | غیر مشتعل | ||
| ترکیبات مرتبط | |||
| مرتبط با اسیدهای قوی | نیتریک اسید هیدروکلریک اسید هیدروبرمیک اسید پرکلریک اسید |
||
| ترکیبات مرتبط | سولفید هیدروژن اسید سولفورو پروکسیمونوسولفوریک اسید تری اکسید سولفور Oleum |
||
| به استثنای جایی که اشاره شدهاست در غیر این صورت، دادهها برای مواد به وضعیت استانداردشان داده شدهاند (در 25 °C (۷۷ °F)، ۱۰۰ kPa) | |||
| Infobox references | |||
اسیدهای پر مصرف صنایع آبکاری
توزیع اسیدهای پر مصرف صنایع آبکاری
این شرکت به منظور دسترسی اسان آبکاران منطقه غرب تهران به اسیدهای با کیفیت مناسب آبکاری و با قیمت مناسب اقدام به ایجاد زیر ساخت ذخیره علمی و مناسب اسیدهای پرمصرف (در صنایع ابکاری) نموده است. برای کسب اطلاعات بیشتر با ما تماس حاصل فرمایید:
1. اسید کلرید ریک 29 الی 31 درصد (تولید شده به روش نمکی - و الکترولیز)
2. اسید نیتریک
3. اسید سولفوریک 98%
4. آب مقطر مناسب برای آبکاری با میکرو زیمنس زیر 50
5.تهیه دستگاه تشخیص کیفیت آب - میکرو زیمنس برای آبکاری
نحوه کنترل اسید کلریدریک کارگاهی
ارزیابی آب مقطر ماسب برای آبکاری فلزات - پوشش فلزات
برای مشاهده سایر مقالات نویسنده لطفا کلیک کنید.
مشخصات اسید کلریدریک - جوهر نمک
مناسب آبکاری فلزات (پوشش فلزات)
واحد تحقیق و توسعه شرکت جلاپردازان پرشیا
بر طبق گفته تجربیات این شرکت، اسید کلریدریک مناسب این صنعت غلظت بیشتر از 30 درصد دارد. برای این امر بر طبق جدول زیر، بومه آن باید حداقل 19 باشد و پی اچ آن نیز باید منفی یک باشد
مشخصات اسید کلریدریک
تماس با شرکت جلاپردازان پرشیا 65733152
غلظت مواد خام (اسیدهای پر مصرف و ..)Concentration of raw materials (acids consumed, etc.)
غلظت مواد خام (اسیدهای پر مصرف و ..)
|
آمونیوم هیدروکسید |
اسید فسفریک |
اسید سولفوریک | اسید نیتریک | اسید کلریدریک | |
| 0.90 | 1.69 | 1.84 | 1.41 | 1.18 |
وزن ویژه |
| 29.0% | 85.0% | 96.5% | 70.0% | 37.3% | درصد میانگین اسید یا باز موجود بر حسب غلظت |
| 535 | 1436 | 1772 | 989 | 442 | وزن اسید یا باز(برحسب گرم) بر لتیر محلول معرف(reagent) (میانگین) |
| 35.05 | 98.0 | 98.08 | 63.02 | 36.47 | وزن مولکولی |
| 15 | 44 | 36 | 16 | 12 | نرمالیته ی ماده معرف (reagent) تغلیظ شده |
| 66 | 23 | 28 | 64 | 83 | حجم مورد نیاز(بر حسب ml) برای ساخت یک لیتر از محلول1N |
غلظت اسید کرومیک در الکترولیت - ارتباط بومه و گرم درلیتر کرومیک اسید CrO3
غلظت CrO3 در الکترولیت کروم
| وزن مخصوص یا چگالی | غلظت CrO3 | وزن مخصوص یا چگالی | غلظت CrO3 | |||
| g/cm3 | بومه oBe | گرم در لیتر g/l | g/cm3 | بومه oBe | گرم در لیتر g/l | |
| 1.01 | 1.5 | 15 | 1.16 | 30.0 | 229 | |
| 1.02 | 3.0 | 29 | 1.17 | 21.0 | 243 | |
| 1.03 | 4.0 | 43 | 1.18 | 22.0 | 257 | |
| 1.04 | 5/5 | 57 | 1.19 | 23.0 | 272 | |
| 1.05 | 7.0 | 71 | 1.20 | 24.0 | 288 | |
| 1.06 | 8.0 | 85 | 1.21 | 25.0 | 301 | |
| 1.07 | 9.5 | 100 | 1.22 | 26.0 | 316 | |
| 1.08 | 10.5 | 114 | 1.23 | 27.0 | 330 | |
| 1.09 | 12.0 | 129 | 1.24 | 28.0 | 345 | |
| 1.10 | 13.0 | 143 | 1.25 | 29.0 | 360 | |
| 1.11 | 15.5 | 157 | 1.26 | 30.0 | 375 | |
| 1.12 | 15.5 | 171 | 1.27 | 31.0 | 390 | |
| 1.13 | 16.5 | 185 | 1.28 | 31.5 | 406 | |
| 1.14 | 18.0 | 200 | 1.29 | 32.5 | 422 | |
| 1.15 | 19.0 | 215 | 1.30 | 33.5 | 438 | |
اسیدهای پر مصرف صنایع آبکاری
توزیع اسیدهای پر مصرف صنایع آبکاری
این شرکت به منظور دسترسی اسان آبکاران منطقه غرب تهران به اسیدهای با کیفیت مناسب آبکاری و با قیمت مناسب اقدام به ایجاد زیر ساخت ذخیره علمی و مناسب اسیدهای پرمصرف (در صنایع ابکاری) نموده است. برای کسب اطلاعات بیشتر با ما تماس حاصل فرمایید:
1. اسید کلرید ریک 29 الی 31 درصد (تولید شده به روش نمکی - و الکترولیز)
2. اسید نیتریک
3. اسید سولفوریک 98%
4. آب مقطر مناسب برای آبکاری با میکرو زیمنس زیر 50
5.تهیه دستگاه تشخیص کیفیت آب - میکرو زیمنس برای آبکاری
نحوه کنترل اسید کلریدریک کارگاهی
ارزیابی آب مقطر ماسب برای آبکاری فلزات - پوشش فلزات
آنالیز اسید بوریک
دستورالعمل 9006-01-07:
انالیز اسید بوریک:
وسایل و مواد لازم
1. پیپت 2 میلی لیتری
2. ارلن مایر 250
3. بورت
4. ترازو
5. محلول پتاسیم هگزاسیانوفرات (280 گرم پتاسیم هگزاسیانوفرات در بالن یک لیتری با اب مقطر به حجم رسانده شود)
6. مانیتول
7. محلول شناساگر برموکروزول ارغوانی0.1 %(1 گرم برومو کروزول در یک بالن یک لیتریبا اب مقطر به حجم رسانده شود)
8. محلول هیدروکسید سدیم 0.1 نرمال
9. اب مقطر
روش انجام
10. 2 میلی لیتر از محلول نمونه را به کمک پیپت داخل ارلن مایر بریزید
11. به محلول ارلن 100 میلی لیتر اب اضافه کنید
12. مقدار 10 میلی لیتر محلول پتاسیم هگزا سیانو فرات به محلول بالا اضافه کنید
13. 6 قطره از محلول شناساگر برموکروزول به ارلن اضافه کنید
14. به محلول بالا 5 گرم مانیتول اضافه کنید
15. حال محلول اماده شده را بوسیله سود 0.1نرمال تا تغییر رنگ از زرد تا ابی -بنفش تیتر کنید
16. محاسبه
حجم مصرفی بورت * 3.1= g/lاسید بوریک
نحوه آنالیز اسید کلریدریک
نحوه ارزیابی اسید کلریدریک بصورت کارگاهی
تست اسید کلریدریک
اسید کلریدریک ورودی به دو صورت مورد تست قرار می گیرد تا مشخص شود که چند درصد است.
تست با کد JP-H02
با استفاده از بومه؛ که بومه اسید اندازه گیری می شود بومه بیش از 19 نشان دهنده اسید بیش از 30درصد وزنی است و قابل قبول است.
تست با کد JP-H01
مقدار درصد وزنی اسید کلریدریک در این روش به وسیله سود یک دهم نرمال مورد آنالیز قرار می گیرد.
روش انجام
1. ابتدا 5 میلی لیتر از اسید را برداشته و در بالن 500 میلی لیتری به حجم می رسانیم تا محلول یک درصد اسید کلریدریک اولیه حاصل شود.
2.با سود یک دهم نرمال تیتر شود
3.از فنل فتالین به عنوان معرف استفاده می شود
4.اگر مقدار سود بیش از 9.5 ؟ درجه شود، بدانمعنی است اسید کلریدریک اولیه 9.5 مولار بوده (30 درصدوزنی) و این قابل قبول است.
5. در صورت بدست آمدن اعداد دیکر از جدول مشخصات اسید کلریدریک کمک میگیریم.
مشخصات اسید کلریدریک مناسب برای آبکاری
جدول ارتباط بومه و میزان اسید کرومیک وان
وان محلول اچ در آبکاری پلاستیک و وان کرم در ابکاری های نیکل کروم و ابکاری پلاستیک
Alternate Method for Chromic Acid
| g/l | Baume | g/l | Baume | g/l | Baume | |
| 300 | 25 | 143 | 13 | 16 | 1.5 | |
| 307 | 25.5 | 149 | 13.5 | 21 | 2 | |
| 314 | 26 | 153 | 14 | 24 | 2.5 | |
| 322 | 26.5 | 159 | 14.5 | 31 | 3 | |
| 330 | 27 | 165 | 15 | 36 | 3.5 | |
| 338 | 27.5 | 172 | 15.5 | 41 | 4 | |
| 345 | 28 | 178 | 16 | 47 | 4.5 | |
| 353 | 28.5 | 184 | 16.5 | 51 | 5 | |
| 362 | 29 | 191 | 17 | 56 | 5.5 | |
| 369 | 29.5 | 197 | 17.5 | 62 | 6 | |
| 377 | 30 | 204 | 18 | 67 | 6.5 | |
| 386 | 30.5 | 211 | 18.5 | 73 | 7 | |
| 395 | 31 | 218 | 19 | 78 | 7.5 | |
| 405 | 31.5 | 224 | 19.5 | 83 | 8 | |
| 414 | 32 | 230 | 20 | 89 | 8.5 | |
| 422 | 32.5 | 236 | 20.5 | 95 | 9 | |
| 431 | 33 | 243 | 21 | 101 | 9.5 | |
| 440 | 33.5 | 250 | 21.5 | 107 | 10 | |
| 450 | 34 | 257 | 22 | 113 | 10.5 | |
| 459 | 34.5 | 263 | 22.5 | 119 | 11 | |
| 467 | 35 | 270 | 23 | 124 | 11.5 | |
| 476 | 35.5 | 278 | 23.5 | 130 | 12 | |
| 486 | 36 | 287 | 24 | 137 | 12.5 | |
کتاب سازه های ضد اسید
کتاب سازه های ضداسید
معرفی
این کتاب، نخستین مرجع سازههای ضداسید و انواع پوششهای ضدخوردگی در ایران است. این مرجع بر مبنای استانداردهای معتبر اروپایی شامل موضوعاتی در زمینههای: انتخاب مواد، طراحی و مهندسی و اجرای انواع آجرکاری و کاشیکاری ضداسید، پوششهای رزینی یکپارچه، رابرلاینینگ و ترموپلاستیک لاینینگ و ... است.
کتاب فوق میتواند در صنایع مختلف مانند، نفت، گاز و پتروشیمی، صنایع شیمیایی، نیروگاههای حرارتی و آبی، صنایع فلزی (آهنی و غیرآهنی)، آبکاری، نظامی، غذایی، لبنی و دارویی که انواع مواد خورنده را در واحدهای خود تولید کرده و یا از آنها استفاده میکنند، مورد استفاده قرار گیرد.
استفاده از این کتاب برای مدیران پروژه، مهندسان مشاور و پیمانکاران فعال در پروژههای صنعتی که در پروژههای آنها بهانواع پوششهای ضدخوردگی نیاز است، مفید خواهد بود.
تالیف: مهندس پوریا آذربخت
ناشر: انتشارات نظری
تعداد صفحات: 512 ص
تلفن سفارش: 88104441
قیمت: 180000 ریال